药用野生稻基因组DNA提取方法比较
作者: 毕继安 王芳 张国芳 朱宏芬 沈岚 郑红英 严成其
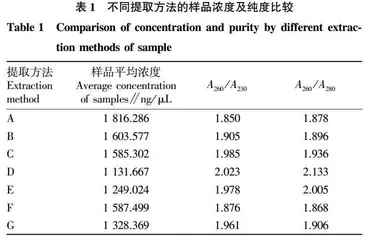
摘要 以药用野生稻为试验材料,分别选用传统的CTAB提取法、CTAB改良方法、碱裂解法、磁珠法、吸附柱法、尿素提取法及酶消化法7种方法提取水稻叶片组织DNA,7种方法分别标记为A~G。通过比较这些方法提取出DNA的浓度和纯度,分析这些方法的优劣势。7种方法均能获得较好的基因组,按获得DNA浓度表现为A>B>F>C>G>E>D,纯度表现为D>E>C>G>B>F>A。综合考量DNA的纯度、浓度、提取时间、成本、安全无毒等方面因素,若对基因组的质量要求不高,只是做简单的检测且考虑成本问题,可以选择CTAB提取法、CTAB改良方法和尿素提取法;若需要高纯度基因组,可以选择磁珠法、吸附柱法、碱裂解法;若考虑安全无毒、快速提取及成本可控,可以选择磁珠法、吸附柱法;若样品稀有,可以选用CTAB提取法和CTAB改良法。
关键词 药用野生稻;叶片;基因组;提取方法;有利基因
中图分类号 S511 文献标识码 A 文章编号 0517-6611(2023)14-0086-04
doi:10.3969/j.issn.0517-6611.2023.14.021
开放科学(资源服务)标识码(OSID):
作者简介 毕继安(1987—),男,山东青岛人,博士,从事抗病育种研究。
*通信作者,研究员,博士,从事抗病育种研究。
药用野生稻多生长于海拔600~1 100 m丘陵山坡中下部的冲积地和沟边,为喜暖、喜雨、喜潮湿的短日照植物,适宜在阴蔽、腐殖质丰富、pH为6左右的肥沃砂壤土上生长。药用野生稻在稻属22个种中长势最强,是普通栽培稻的20倍以上,在进化过程中,药用野生稻形成了丰富的遗传多样性,药用野生稻因长期处于野生环境,经受各种自然灾害和地理生态因素的考验,形成了较强的抗性和耐受不良环境因素等方面的优异性状,是天然的基因库。药用野生稻农艺性状具有大穗、宽叶片、粗茎秆等性状,为遗传改良提供了良好的资源条件。因此,深入挖掘药用野生稻的优良基因对于新种质创新具有重要意义。①大量的抗病基因。有研究人员通过对抗病基因的克隆以及高抗条纹叶枯病水稻材料的获得,使药用野生稻资源得到了充分利用,更进一步推动了药用野生稻抗病基因的开发与研究[ 1]。水稻白叶枯病是水稻生长发育过程中常见的病害,而药用野生稻具有大量的优异抗性基因,因此从药用野生稻中挖掘抗白叶枯病基因并加以利用,得到了广大科研工作者的高度重视。研究发现,云南药用野生稻多个居群类型对4种主要病害存在一定抗性[ 2-3],云南药用野生稻种质资源对当地一定时期流行的白叶枯病小种及国内外部分强致病菌整体抗性较好[ 4],这些研究为药用野生稻的有效抗病基因挖掘奠定了基础。②创制新种质资源。研究发现,利用构建药用野生稻TAC文库筛选有利基因并通过克隆、遗传转化方法及结合育种技术,有望实现药用野生稻在新种质资源上的创制[ 5-7]。同时,栽培稻与药用野生稻种间杂种体内异源基因组重组引起的DNA甲基化变异规律为不对称体细胞杂交的基因融合奠定了基础[ 8],有研究发现,将药用野生稻总DNA通过穗茎注射法导入恢复系R225可以创制耐阴、耐光氧化的水稻新种质[ 9]。③优异内源基因的挖掘。有研究表明,云南药用野生稻净光合速率较高,其在羧化效率和光饱和点上所表现出的高光效潜能为探索机体高光效基因提供了理论依据[ 10-11]。药用野生稻中淀粉合成酶基因在同属内的自然进化规律的探索,也为水稻的遗传育种和品质改良提供科学依据[ 12-13]。④抗逆途径基因挖掘。有研究人员通过基于药用野生稻干旱胁迫转录组数据分析探索ADF基因对药用野生稻非生物胁迫的影响[ 14],同时还有研究表明,药用野生稻中LEA蛋白在植物抗逆反应起着重要的作用,这为水稻遗传改良提供重要的理论依据[ 11,15]。上述研究说明药用野生稻中药用野生稻中存在大量、有利、可挖掘的基因,是种质创新的有利基因库,而组织样品的提取方法还不够完善与全面,这将会导致存在部分有利基因片段获取不够完整,因此选择一种合适的方法提取药用野生稻基因组DNA对于有利基因的深入挖掘至关重要。药用野生稻因其生理结构特征比栽培稻较为复杂,其基因组提取相对困难,提取质量相对偏低,因此对药用野生稻DNA提取方法进行探索,优化提取步骤,为获得更加合适、更加完整的基因组结构提供理论依据。笔者以药用野生稻为素材,综合采用7种方法来提取植物的基因组,比较各种方法所提取的基因组含量与纯度,旨在为后序深入挖掘药用野生稻的有利基因提供技术依据。
1 材料与方法
1.1 试验材料
药用野生稻为该试验培育,准备药用野生稻相同叶位的7组样品,每组样品准确称取0.6 g,然后三等分。
主要试剂:聚乙烯吡咯烷酮(生工生物工程(上海)股份有限公司,中国),β-巯基乙醇(索莱宝生物科技有限公司,中国),Protein K(索莱宝生物科技有限公司,中国),磁珠(美国Promega公司,US),DNA提取试剂盒(QIAGEN,Germany),R-淀粉酶(美国Sigma公司,US)。主要仪器:组织研磨仪(Tissuelyser-96,上海净信实业发展有限公司),离心机(5424R,德国艾本德股份公司),恒温水浴锅(DK-8D,上海一恒科学仪器有限公司),超微量紫外分光光度计(NanoDrop One C,US)。
1.2 试验方法
1.2.1 基于CTAB的经典DNA提取方法。
①取0.2 g水稻叶片组织于液氮中研磨成细粉状,并将粉末快速转移到2 mL离心管中。
②加入500 μL提取缓冲液[2% CTAB,100 mmol/L Tris-HCl(pH 7.4),50 mmol/L EDTA (pH 8.0),1.4 mol/L NaCl,0.2% β-巯基乙醇],颠倒混合均匀离心管,将混合物置于65 ℃水浴中孵育30 min,每隔10 min颠倒混匀一次。
③将离心管置于离心机中,12 000 r/min 离心15 min。转移离心管中上层液体到新的 1.5 mL 离心管中。
④加入200 μL苯酚∶氯仿∶异戊醇(25∶24∶1)到离心管中并颠倒混合均匀,于室温静置5 min,将离心管置于离心机中,12 000 r/min 离心10 min,转移离心管中上层液于新的 1.5 mL 离心管中。
⑤加入200 μL 氯仿∶异戊醇(24∶1)溶液轻轻颠倒混匀,于室温静置5 min后,将其置于离心机中,12 000 r/min 离心10 min,转移离心管的上层液体到新的 1.5 mL 离心管中。⑥加入2倍体积的冷乙醇(预先于-20 ℃保存),轻混匀,并转移到-20 ℃冰箱中静置30 min。
⑦将离心管置于离心机中,14 000 r/min 离心2 min,弃上清。
⑧加入洗涤缓冲液(70% 乙醇,10 mmol/L醋酸铵),重悬沉淀,12 000 r/min 离心1 min,弃上清。重复该操作步骤一次。
⑨将沉淀置于空气中干燥并用100 μL 超纯水将其溶解,并将其置于37 ℃水浴锅中孵育30 min。最后将其置于-20 ℃冰箱中备用或用于后续试验[ 16-17]。
1.2.2 基于CTAB提取DNA方法的改良。
①取0.2 g水稻叶片和0.1 g聚乙烯吡咯烷酮于液氮中研磨成粉末。
②将粉末转移至2 mL离心管中。随后将1 mL预冷提取缓冲液(100 mmol/L Tris-HCl、50 mmol/L EDTA、500 mmol/L NaCl和2% β-巯基乙醇,最终调节pH至8.0)加入离心管中,涡旋振荡混合物,并在室温下静置10 min。然后将离心管于4 ℃ 12 000 r/min下离心10 min,弃上清。
③将沉淀悬浮于1 mL预热的提取缓冲液中(3% CTAB、1.4 mmol/L NaCl、100 mmol/L Tris-HCl、0.5 mol/L EDTA和2% β-ME,pH为80),与此同时加入20 μL Protein K 并将混合物于65 ℃水浴下孵育至少1 h,同时每隔20 min颠倒混匀一次,然后将混合物于4 ℃ 12 000 r/min下离心10 min。
④将上清液转移到新的 2 mL 离心管中,然后向离心管中加入等体积的氯仿∶异戊醇(24∶1)。颠倒混匀后置于室温下静置10 min,然后于4 ℃ 12 000 r/min 离心10 min。
⑤将水相转移到新的2 mL离心管中。加入大约1/10体积的 2.5 mol/L KAC溶液(pH 5.2)。
⑥将上层水相转移到另一个新的2 mL 管中,加入1/3体积的冰异丙醇溶液。将离心管静置于-20 ℃冰箱中30 min,随后在 4 ℃12 000 r/min下离心10 min。
⑦弃上清,用多糖、多酚洗涤缓冲液(含50 mmol/L Tris-HCl、5 mmol/L EDTA、350 mmol/L 山梨糖醇,pH 8.0)洗涤1次。
⑧弃掉上清液,将含有DNA的白色沉淀用70%乙醇洗涤2次,自然环境干燥。
⑨将最终的DNA沉淀用100 μL 超纯水溶解[ 18-19]。
1.2.3 碱裂解法。
①取0.2 g水稻叶片组织于液氮中研磨成细粉状,接着将其转移到2 mL离心管中。
②在离心管中加入100 μL碱性裂解试剂[25 mmol/L NaOH 和 0.2 mmol/L EDTA(PH 8.0)],随后添加100 μL 缓冲试剂[40 mmol/L Tris-HCl(pH 5)]并混匀,静置2 min。
③将离心管置于离心机中12 000 r/min 离心5 min,取上清液。
④上清液中加入20 μL 蛋白酶 K(20 mg/mL)及5 μL RNase(10 mg/mL)后于37 ℃水浴锅中孵育30 min,再将其置于65 ℃水浴锅孵育10 min。
⑤加入200 μL 氯仿∶异戊醇(24∶1)溶液并轻轻颠倒混匀,静置5 min后,将其置于离心机中,12 000 r/min 离心10 min,转移离心管中的上层液体到新的 1.5 mL 离心管中。
⑥加入2倍体积的冷乙醇(预先于-20 ℃保存),轻混匀,并于-20 ℃冰箱中静置30 min。
⑦将离心管置于离心机中,14 000 r/min 离心2 min,弃上清。
⑧加入70%乙醇溶液重悬沉淀,12 000 r/min 离心1 min,弃上清;重复该操作步骤 1次。
⑨室温条件下晾干沉淀,加入100 μL超纯水充分溶解,保存于-20 ℃冰箱中待用[ 20]。
1.2.4 磁珠法。
①取0.2 g水稻叶片组织于液氮中研磨成粉末,并将粉末转移到2 mL 离心管中,并加入1 mL裂解缓冲液(2% CTAB、2.5 mmol/L NaCl、0.1 mol/L Tris-HCl、20 mmol/L EDTA),颠倒混匀。
②将上述混合物通过0.22 μm 过滤器,转移到新2 mL离心管中,在滤液中加入800 μL异丙醇和50 μL蛋白酶K,充分混匀。
③在滤液中加入20 μL 磁珠原液并涡旋3~4 min,静置1 min。
④将混合物置于磁力架沉淀磁珠,弃去上清中不含磁珠的液体。
⑤磁珠用 1 mL CW1 缓冲液(含7 mol/L盐酸胍的50%异丙醇溶液)进行清洗。
⑥磁珠再用 1 mL CW2 缓冲液(75%乙醇)洗涤2次。随后室温放置 5 min以蒸发残留的乙醇。