猪MMP9基因的多态性与产仔数性状的关联分析
作者: 刘林清 李庆岗 苏世广 周梅 张威 王重龙
摘要 通过比较序列测定法,在MMP9基因第10内含子发现C/T突变,建立了PCR-SmaI-RFLP分型技术,并在淮猪新品系Ⅱ猪种中进行多态性分型,分析其基因型频率和等位基因频率,检测该位点的多态性并与产仔数性状进行关联分析。结果表明,在淮猪新品系Ⅱ猪群中,所有胎次产仔数呈TC>CC>TT的趋势,TC型个体的所有胎次产仔数显著高于CC型个体0.776头(P<0.05)。因此,MMP9基因在淮猪新品系Ⅱ猪群中与产仔数性状显著相关,为提高猪产仔数性状提供一个有用的分子标记。
关键词 猪;MMP9;产仔数;关联分析
中图分类号 S814 文献标识码 A 文章编号 0517-6611(2023)19-0090-02
doi:10.3969/j.issn.0517-6611.2023.19.018
Analysis of Relationship between Polymorphisms of Porcine MMP9 Gene with Litter Size Trait
LIU Lin-qing,LI Qing-gang,SU Shi-guang et al
(Institute of Animal Husbandry and Veterinary Medicine,Anhui Academy of Agricultural Sciences,Anhui Provincial Key Laboratory of Livestock and Poultry Product Safety Engineering,Hefei,Anhui 230031)
Abstract By comparision of the sequences of MMP9 gene,a C/T mutation in intron 10 was found and developed a PCR-SmaI-RFLP genotyping assay.Genotype frequencyies and allele frequencies of this SNP were investigated in new strain Huai pig Ⅱ.Association of the SNP and litter size was assessed in new strain Huai pig Ⅱ.Statistical analysis demonstrated that it showed the tendency of TC>CC>TT in all parity.In addition,those with the TC genotype had additional 0.776 piglets born compared to the CC animals(P<0.05) in new strain Huai pig Ⅱ.Therefore,MMP9 gene has significant associated with litter size in new strain Huai Pig Ⅱ,could be a useful molecular marker in selection for increasing litter size in pigs.
Key words Pig;MMP9;Litter size;Association
MMPs作为一类活性依赖于锌离子的肽链内切酶,在卵泡和子宫外组织的动态变化中发挥一定的调控作用。MMPs的合成与分泌与卵泡破裂卵子排出的生化反应有关,包括生长因子、细胞因子、孕酮、前列腺素和蛋白水解酶等。并且蛋白水解酶可以通过降解卵泡壁结缔组织,从而促进排卵[1]。增强MMP的活性可加速降解卵泡细胞外基质,抑制MMP活性后,排卵过程某种程度上受到抑制[2-4]。MMP9作为MMPs的家族成员之一,参与降解IV型胶原底物,IV型胶原是基膜的主要成分且其他基膜元件也可通过IV型胶原相结合,从而在繁殖组织的发育和重塑过程中发挥重要作用[5-6]。研究发现,MMP9及其抑制因子TIMP2参与胚泡对子宫内膜的侵入[7]。Robker等[8]研究发现,在小鼠内源LH峰或hCG处理后,MMP9基因表达量上升。这些研究结果进一步暗示了MMP9 基因在卵泡的发育和排卵过程中发挥作用。
为此,笔者建立了MMP9 基因的PCR-SmaI-RFLP分型技术,并在淮猪新品系Ⅱ猪群中进行多态性分型,检测该位点的多态性及其与产仔数性状进行关联分析,以期为提高猪产仔数提供一个有用的分子标记。
1 材料与方法
1.1 材料 试验地点在安徽省科鑫养猪育种有限公司;于2014年7月采集85头淮猪新品系Ⅱ系猪的耳组织,放置于75%乙醇的离心管中,-20 ℃保存备用。
1.2 方法
1.2.1 DNA提取。采用苯酚-氯仿抽提法,TE溶解,-20 ℃冷冻保存。
1.2.2 引物的设计与合成。根据MMP9基因DNA序列,应用Premier 5.0软件在多态位点(第10内含子)两侧,设计一对引物,突变位点可用限制性内切酶SmaI识别,引物由上海生工生物公司合成。引物信息:MMP9基因的上游引物5′-TCATGTCCCCAGGAAGTAC -3′,下游引物5′-GGCCCAACTTATCCAGAC -3′,片段长度为559 bp,退火温度为55.6 ℃。
1.2.3 PCR扩增。PCR反应体系为25 μL,其中PCR 2×Taqmix 12.5 μL,10 mmol/μL的引物各0.5 μL,DNA模板1.0 μL(DNA约100 ng),加ddH2O至25 μL。PCR反应条件为第1步95 ℃变性5 min;第2步95 ℃变性45 s;第3步55.6 ℃复性40 s;第4步72 ℃延伸35 s;重复第2~4步35个循环,之后72 ℃延伸10 min,最后降温至4 ℃保存。PCR扩增产物用2.0%的琼脂糖凝胶电泳,核酸染料染色,凝胶成像系统中观察,可见到片段大小为559 bp的清晰条带。
1.2.4 限制性内切酶酶切(RFLP)。MMP9基因的PCR产物用SmaI内切酶酶切,反应体系:10×Buffer 1.0 μL,SmaI酶0.3 μL(10 U/μL),加PCR产物至10 μL;37 ℃反应8~12 h;酶切产物在2.0%琼脂糖凝胶中电泳,核酸染料染色,凝胶成像系统中观察。
1.3 数据分析
1.3.1 统计分析的软件。采用SAS 8.0统计软件(SAS Institute Inc,Version 8 Edition)的GLM程序进行方差分析,并进行显著性检验。
1.3.2 基因效应统计分析模型。依据Liu[9]的方法建立的单标记回归统计模型,除猪个体为随机效应外,其他因素均为固定效应。所采用模型Y=平均值+基因型+胎次效应+残差,其中Y为性状表型值。
2 结果与分析
2.1 猪MMP9基因的多态位点检测
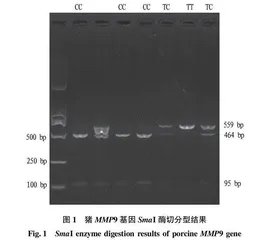
PCR扩增片段长度为559 bp,经SmaI酶切后产生3种基因型(图1)。当多态位点为CC基因型时,则造成了SmaI酶切位点,PCR产物经SmaI消化后产生2个片段(464 bp+95 bp),记为等位基因C;当多态位点为TT基因型时,则酶切位点消失,PCR产物经SmaI消化后产生1个片段(559 bp),记作等位基因T。
2.2 猪MMP9基因在淮猪新品系II系猪群体中的基因型和等位基因的频率分布
MMP9基因SmaI酶切位点在所检测的猪群中,基因型TT、TC、CC频率分别为0.05、0.39、0.56,C等位基因占优势(0.76),T等位基因频率为0.24。
2.3 猪MMP9基因SmaI多态位点基因型与猪产仔数性状的关联分析
应用基因效应统计分析模型[9],采用SAS统计软件的GLM程序在淮猪新品系II系猪群体中进行猪MMP9基因PCR-SmaI-RFLP多态位点与产仔数性状的关联分析。
在淮猪新品系II系猪群体中,所有胎次产仔数均呈TC>CC>TT的趋势。其中,TC型个体的所有胎次产仔数显著高于CC型个体0.776头(P<0.05)(表1)。统计结果显示,TC型和CC型母猪具有较高的产仔数,C等位基因为优势等位基因。
3 讨论
淮猪新品系Ⅱ是以安徽省优良地方品种淮猪为母本,以国外优质瘦肉型品种长白猪、大白猪为父本,经过杂交育种组建基础群,然后运用标记辅助选择BLUP估计育种值进行群体继代选育。MMPs作为一类活性依赖于锌离子的肽链内切酶,在卵泡和子宫外组织的动态变化中发挥一定的调控作用。MMP9作为MMPs的家族成员之一,参与降解IV型胶原底物,在繁殖组织的发育和重塑过程中发挥重要作用[5-6]。且研究发现,在小鼠内源LH峰或hCG处理后,MMP9基因表达量上升[8,10]。此外,Dubois等[11]研究发现,MMP9基因敲除小鼠后,配种率下降,头胎和经产产仔数均低于正常小鼠。这进一步暗示了MMP9 基因在卵泡的发育和排卵过程中发挥作用。
基因敲除试验表明,MMP9基因敲除小鼠配种率下降,头胎和经产窝产鼠数均低于正常小鼠[12]。结合MMP9在胚胎着床中的重要作用,推断该基因对猪产仔数有重要影响。
该研究发现,MMP9基因SmaI酶切位点在淮猪新品系II系猪群体中检测发现C等位基因占优势,且在所有胎次产仔数呈TC>CC>TT的趋势。其中,TC型个体的所有胎次产仔数显著高于CC型个体0.776头(P<0.05),表明TC型和CC型母猪具有较高的产仔数,C等位基因为优势等位基因,因此在今后选育中可适当提高C等位基因的频率。
参考文献
[1]ESPEY L L,LIPNER H.Ovulation[M]//KNOBIL E,NEILL J D.The physiology of reproduction.New York:Raven Press,1994:725-780.
[2] ICHIKAWA S,OHTA M,MORIOKA H,et al.Blockage of ovulation in the explanted hamster ovary by a collagenase inhibitor[J].J Reprod Fertil,1983,68(1):17-19.
[3] BRNNSTRM M,WOESSNER J F,JR,KOOS R D,et al.Inhibitors of mammalian tissue collagenase and metalloproteinases suppress ovulation in the perfused rat ovary[J].Endocrinology,1988,122(5):1715-1721.
[4] GOTTSCH M L,VAN KIRK E A,MURDOCH W J.Role of matrix metalloproteinase 2 in the ovulatory folliculo-luteal transition of ewes[J].Reproduction,2002,124(3):347-352.
[5] CURRY T E,JR,OSTEEN K G.The matrix metalloproteinase system:Changes,regulation,and impact throughout the ovarian and uterine reproductive cycle[J].Endocr Rev,2003,24(4):428-465.
[6] ZHANG X,NOTHNICK W B.The role and regulation of the uterine matrix metalloproteinase system in menstruating and non-menstruating species[J].Front Biosci,2005,10:353-366.