棉铃虫CCE001a蛋白结构与功能的生物信息学分析
作者: 张莉 王海亮 马雪儿 牛俊丽 陈程 张文举
摘要 [目的]深入预测CCE001a蛋白结构与生物学功能。[方法]使用生物信息学方法预测CCE001a基因所编码的蛋白质,预测其功能与结构。[结果]该蛋白的总氨基酸残基数为556个,分子式为C2865H4321N737O811S23,蛋白的等电点pI为5.32,带正电的氨基酸残基(Arg+Lys)为58 个,带负电的氨基酸残基(Asp+Glu)为75个,蛋白不稳定系数为35.22,脂肪系数为75.91,总平均亲水性系数为-0.262;CCE001a蛋白有一个脱氢酶超家族(cl21494)结构域;经分析显示,α-螺旋、无规律的卷曲是这种蛋白质的主要二次结构,分别占31.35%和46.49%,还包括3.96%的β-转角和18.20%的扩展延伸链。经过三级结构学预测表明,该蛋白包括α-螺旋、β-转角;该蛋白亚细胞被确认为定位在内质网内,存在着信号肽的序列,初步可以认为是具有分泌力的亲水蛋白,且没有出现跨膜蛋白,共有37个磷酸化位点,1个N-糖基化位点。[结论]该研究可为研究CCE001a的解毒机制提供理论基础。
关键词 CCE001a;羧酸酯酶;解毒;蛋白质修饰位点;生物信息
中图分类号 S 435.622+.3 文献标识码 A 文章编号 0517-6611(2022)01-0102-04
doi:10.3969/j.issn.0517-6611.2022.01.026
Bioinformatics Analysis of the Protein Structure and Function of Helicoverpa armigera CCE001a
ZHANG Li, WANG Hai-liang, MA Xue-er et al
(College of Animal Science and Technology, Shihezi University, Shihezi, Xinjiang 832000)
Abstract [Objective]In order to further predict the protein structure and biological function of CCE001a.[Method]This study used a bioinformatics method to predict the protein encoded by this gene, and predict its function and structure. [Result] The prediction results show that the total number of amino acid residues of the protein is 556, its molecular formula is C2865 H 4321N737O811S23, the isoelectric point pI of the protein is 5.32, and the positively charged amino acid residues (Arg+Lys) are 58, which are negatively charged. There are 75 amino acid residues (Asp+Glu), protein instability coefficient is 35.22, fat coefficient is 75.91, total average hydrophilicity coefficient is -0.262; CCE001a protein has a dehydrogenase superfamily (cl21494) domain; analysis shows that α-helix and irregular coils are the main secondary structures of this protein. They account for 31.35% and 46.49%, respectively, including 3.96% of β-turns and 18.20% of extended stretched chains. After tertiary structural prediction, it is shown that the protein includes α-helix and β-turn; the protein subcellular is confirmed to be located in the endoplasmic reticulum, and there is a signal peptide sequence, which can be initially considered as secretory Hydrophilic protein, and no transmembrane protein, a total of 37 phosphorylation sites, one N-glycosylation site. [Conclusion]This study can provide a theoretical basis for studying the detoxification mechanism of CCE001a.
Key words CCE001a;Carboxylesterase;Detoxification;Protein modification sites;Biological information
基金项目 国家自然科学基金“棉铃虫棉酚降解酶的高活性筛选及其酶学特性与降解机理”(31860660);石河子大学高层次人才科研启动资金专项“基于棉酚降解相关基因的热带假丝酵母遗传转化及应用项目”(RCZK2019)。
作者简介 张莉(1997—),女,甘肃天水人,硕士研究生,研究方向:饲料资源的开发与利用。
通信作者:陈程,讲师,从事饲料资源的开发与利用研究;张文举,教授,从事饲料资源的开发与利用研究。
收稿日期 2021-05-24;修回日期 2021-06-11
羧酸酯酶(CarEs)是一类主要的解毒酶,与各种昆虫的抗药性有关[1]。羧酸酯酶普遍存在于动物、植物和微生物中,在包括羧酸酯在内的异生化合物水解成相应的醇和羧酸的过程中发挥着关键作用[2]。昆虫中参与多种类型杀虫剂解毒作用的物质可能是1个或多个酶系,这些杀虫剂包括拟除虫菊酯、有机磷和氨基甲酸酯。在人类大量使用有机磷、拟除虫菊酯杀虫剂的形势下,对棉花危害较大的害虫棉铃虫(Helicoverpa armigera)产生了较严重的抗药性[3]。CarEs是一类主要负责异生素化学物质的解毒酶,因此在棉铃虫抗药性中起关键作用[4]。次生代谢物是植食性昆虫及其寄主植物共同进化中的一组重要介质。由于其幼虫在棉花上觅食和生长,棉铃虫可通过解毒和螯合机制耐受棉花植物产生的主要防御代谢物棉酚[5]。当受到昆虫攻击时,宿主植物会产生次生代谢物作为防御的一部分,而昆虫在进食时会产生解毒酶来抵消次生代谢物。通常情况下,代谢排毒途径一般可以分为3个阶段。第1阶段的酶,细胞色素P450单加氧酶或羧酸酯酶直接作用于毒素分子,增加其官能团的亲水性和反应性。第2阶段,疏水性和毒性化合物通过谷胱甘肽 S-转移酶(GSTs)的作用转化为亲水性产物,促进其排泄。最后,依靠ATP结合盒(ABC)和主要的膜转运蛋白主动将结合的异源物质泵出细胞[6-7]。数据表明,在棉铃虫中至少发现了40种羧酸酯酶[7]。目前,杀虫剂代谢产生活性CarEs的另一种方法是利用异源表达系统。迄今为止,已经用杆状病毒表达系统在昆虫细胞(Sf9)中表达了来自棉铃虫GR菌株的若干CarEs[8],然而,由于昆虫细胞内细胞生长缓慢和表达水平低,只能产生有限数量的酶。一些昆虫基因已经在大肠杆菌系统中进行了功能性表达。例如,利用这种异源表达系统,来自库蚊的突变B1酯酶显示出对4种有机磷酸酯杀虫剂的水解酶活性[9]。苹果蠹蛾的CpCE-1能够代谢乙酰甲胺磷[10]。靳明辉[11]采用qPCR技术筛选6个候选基因,采用qPCR技术对棉铃虫取食棉酚后6个候选基因的表达变化进行了研究,CCE001a基因表达量显著上调(P<0.05),由此可知,基因CCE001a与棉铃虫代谢棉酚有关。因此,了解棉铃虫羧酸酯酶CCE001a蛋白质生化特性和生物活性功能,可能会大大促进对棉铃虫羧酸酯酶解毒棉酚机制的理解。
1 材料与方法
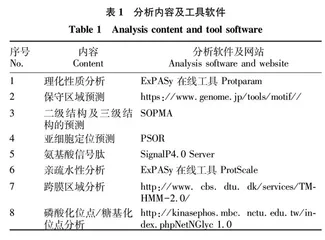
棉铃虫CCE001a蛋白的生物信息学分析内容和使用的软件及网站见表1[12]。
2 结果与分析
2.1 CCE001a蛋白理化性质
CCE001a 蛋白酶的理化特性是通过 ExPASy在线工具 Protparam 来分析,通过分析表明,棉铃虫 CCE001a 的相应分子质量为62 802.66。由表2可知,棉铃虫CCE001a 共含20种氨基酸。该基因所编码的蛋白质氨基酸总计556个,分子式为C2865 H 4321N737O811S23,蛋白等电点PI为5.32,不稳定系数计算为35.22,故将其归类为稳定性蛋白;带正电荷的氨基酸残基总数(Arg + Lys)为58个,带负电荷的氨基酸残基总数(Asp + Glu)为75个,脂肪系数为75.91;亲水性的平均值(GRAVY)为-0.262,为亲水性蛋白。
2.2 CCE001a蛋白保守区域预测
该蛋白的保守序列如图1所示,发现22~530有1个共酯酶家族(PF00135)结构域,在118~206有1个脱氢酶家族(PF07859)结构域。
2.3 CCE001a蛋白二级结构及三级结构的预测
CCE001a蛋白二级组成体系运用SOPMA 网络软件工具进行分析和预测,该蛋白二级结构中,α-螺旋(alpha helix)占31.35%,β-转角(beta turn)占3.96%,无规则卷曲(random coil)占46.49%,扩展链(extended strand)占18.20%(图2)。该蛋白的三级结构(图3)由Phyre2在线预测,该预测模型的蛋白覆盖率为 100%,可信度为 92%。
2.4 CCE001a蛋白亚细胞定位预测
使用PSOR在线工具分析该蛋白的亚细胞定位,结果显示,CCE001a基因编码蛋白主要定位在内质网中,内质网中含有很多参与不同类型解毒作用的酶系,从结合棉铃虫对杀虫剂及植物次生代谢产物来看,CCE001a可能会参与解毒作用,通过氧化还原、水解或结合等反应来代谢有毒的外源物质,或将其转化成为无毒物质排出体外。
2.5 CCE001a蛋白氨基酸序列信号肽预测
使用SignalP4.0 Server在线分析,发现该蛋白存在一个信号肽,存在位置为第17个氨基酸处(图4),初步认为该蛋白为分泌型蛋白。
2.6 CCE001a的蛋白质亲疏水性
经在线分析,预测结果见图5。CCE001a蛋白的亲水性均值(GRAVY)为-0.262,疏水指数最大值为3.011,位于第11位氨基酸上,最小为-2.922,位于第35位氨基酸上。CCE001a蛋白的亲水性氨基酸范围大于疏水性氨基酸范围,故将该预测蛋白归属为亲水性蛋白。
2.7 CCE001a的蛋白质跨膜区的预测
通过TMHMM在线软件对该蛋白质的跨膜螺旋区进行分析,结果如图6所示,CCE001a蛋白的跨膜螺旋区间数为0,且其跨膜螺旋内氨基酸的数目很小,故该蛋白质未形成一定的跨膜结构区,但由于CCE001a蛋白的特殊结构,该预测结果结合亲水性分析结果,表明棉铃虫CCE001a基因编码蛋白为亲水性蛋白,不含有跨膜区。