UdhA和博伊丁假丝酵母xylI基因共表达对木糖醇发酵的影响
作者: 唐梅 蔡松 付声亮 王金华 王永泽
摘要 [目的]研究可溶性吡啶核苷酸转氢酶基因(UdhA)和醛糖还原酶基因(xylI)共表达对木糖醇发酵的影响。[方法]将来源于博伊丁假丝酵母醛糖还原酶xylI基因克隆到pET28a(+)上,并在BL21(DE3)中表达,通过SDS-PAGE对表达产物的分子量和酶活进行测定。随即将xylI基因连接lacP启动子,构建pWYZ-2质粒并将其转化到E.coli AI07菌株。进一步将来源于E.coli W3110的UdhA基因克隆到pWYZ-2质粒实现与xylI共表达,所构建pWYZ-4质粒转化到E.coli AI07菌株,比较了E.coli AI07/pWYZ-2和E.coli AI07/pWYZ-4木糖醇发酵结果。[结果]在BL21(DE3)/pET28a(+)体系诱导表达的醛糖还原酶分子量为39 kD,木糖还原酶酶活为3.30 U/mL。E.coli AI07/pWYZ-2菌株发酵48 h,木糖醇产量为19.90 g/L;E.coli AI07/pWYZ-4发酵36 h,木糖醇产量达到19.91 g/L,较菌株AI07/pWYZ-2生产强度提高了33.25%。[结论]通过将UdhA基因与xylI 基因进行共表达,提高了重组大肠杆菌(E.coli AI07/ pWYZ-4)合成木糖醇的生产强度。
关键词 博伊丁假丝酵母;xylI基因;UdhA基因;共表达;木糖醇
中图分类号 Q 812 文献标识码 A 文章编号 0517-6611(2022)01-0106-04
doi:10.3969/j.issn.0517-6611.2022.01.027
The Effect of Co-expression of UdhA and Candida boidinii xylI Gene on Xylitol Fermentation
TANG Mei, CAI Song, FU Sheng-liang et al
(Hubei Key Laboratory of Industrial Microbiology, Hubei University of Technology, Wuhan, Hubei 430068)
Abstract [Objective] The effect of co-expression of soluble pyridine nucleotide transhydrogenase gene (UdhA) and aldose reductase gene (xylI) on xylitol fermentation was investigated. [Method] xylI gene from Candida boidinii encoding aldose reductase was cloned into pET28a(+) and expressed in BL21(DE3). The enzyme molecular weight was detected by SDS-PAGE and enzyme activity was assayed. xylI gene was ligated to the lacP promoter for construction of plasmid pWYZ-2 and then the plasmid was transformed into E.coli AI07.The UdhA gene derived from E.coli W3110 was further cloned into pWYZ-2 plasmid to achieve co-expression with xylI for pWYZ-4 plasmid construction and then pWYZ-4 was transformed into E.coli AI07. E.coli AI07/pWYZ-2 was compared with E.coli AI07/pWYZ-4 for xylitol fermentation.[Result] The molecular weight of xylose reductase expressed in BL21(DE3)/pET28a(+) system was 39 kD, and the enzymatic activity of aldose reductase was 3.3 U/mL.The E.coli AI07/pWYZ-2 strain was fermented for 48 hours, the xylitol output was 19.90 g/L. E.coli AI07/pWYZ-4 was fermented for 36 hours, xylitol production reached 19.91 g/L, xylitol productivity of E.coli AI07/pWYZ-4 was 33.25% higher than that of strain E.coli AI07/pWYZ-2.[Conclusion]Xylitol productivity of recombinant Escherichia coli was improved using co-expression of UdhA gene and xylI gene.
Key words Candida boydingii;xylI gene;UdhA gene;Co-expression;Xylitol
基金项目 国家“十二五”支撑计划项目(2012BAD27B03);山东创新计划项目(201720311004)。
作者简介 唐梅(1993—),女,湖北广水人,硕士,从事代谢工程及发酵技术研究。通信作者,副教授,从事生物能源与生物材料研究。
收稿日期 2021-04-22
木糖醇广泛存在于各种果蔬食物中,含量却很低[1],其应用范围广,且由于木糖醇在人体内的代谢与胰岛素无关[2-3],故适用于生产糖尿病患者食品。近年来,木糖醇的市场需求不断扩大,国内木糖醇年产值已超过13亿元,预计今后国际市场上木糖醇总需求量将达10万t以上[4]。
通过微生物发酵或者催化获得木糖醇正成为木糖醇合成的热点,醛糖还原酶(也称为木糖还原酶)作为生物合成法中的关键因子,主要存在于酵母和丝状真菌中[4]。目前发现的醛糖还原酶都需要辅酶,其中一类是辅酶NADH依赖型,如来源于近平滑假丝酵母(Candida parapsilosis)[5]的木糖还原酶;另外一类是辅酶NADPH依赖型,如来源于热带假丝酵母(Candida boydingii)[6]、埃默森篮状菌(Talaromyces emersonii)[7]和博伊丁假丝酵母(Candida boidinii)等[8]微生物的醛糖还原酶。对于辅酶NADPH依赖型的木糖还原酶,要提高木糖醇的产量,需要更多的NADPH来满足酶催化的需要。
通常通过表达磷酸戊糖途径的6-磷酸葡萄糖脱氢酶编码基因zwf和6-磷酸葡萄糖酸脱氢酶编码基因gnd来强化NADPH的产出[9];也有敲除EMP途径中编码磷酸果糖激酶的pfkA和pfkB基因,使碳源更多地流向磷酸戊糖途径,从而实现NADPH的供给[10]。
可溶性吡啶核苷酸转氢酶能催化NADH和NADPH相互转化[11],改变了细胞内NADH/NAD+的比例。考虑到糖酵解途径不依赖氧气也能产生大量的NADH,如果将这部分辅因子转化成NADPH形式,将为NADPH的供给提供一个新的途径。在前期产丙酮酸大肠杆菌工程菌构建的工作中,成功将大肠杆菌W3110自身的UdhA基因克隆到载体上,通过诱导表达发现,UdhA的克隆有效地促进了丙酮酸发酵的生产强度[12]。
考虑到博伊丁假丝酵母(Candida boidinii)在木糖醇合成中也存在辅酶NADPH依赖的难题,笔者借鉴丙酮酸工程菌构建的结果,将博伊丁假丝酵母的醛糖还原酶基因xylI进行克隆、表达及酶活测定,并探讨可溶性吡啶核苷酸转氢酶UdhA和xylI共表达对木糖醇发酵的影响,以期为解决NADPH依赖型醛糖还原酶辅因子不足的问题提供新的途径。
1 材料与方法
1.1 材料
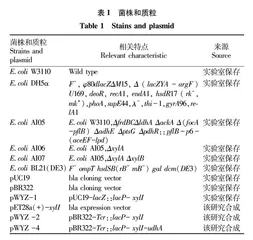
1.1.1 菌株与质粒。所用菌株和质粒见表1。
1.1.2 引物。
引物序列见表2,均由南京金斯瑞生物科技有限公司合成。
1.1.3 主要试剂与仪器。
主要试剂:木糖醇对照品(含量>99.9%),2×Taq polymerase,PrimerSTAR Max DNA Polymerase,其他试剂均为市售分析纯;主要仪器:e2695液相色谱、蛋白电泳仪、凝胶自动成像仪、PCR仪、电转仪。
1.1.4 培养基。
LB液体培养基:酵母粉5 g/L、蛋白胨1 g/L、NaCl 5 g/L。
抗性平板培养基:酵母粉5 g/L、蛋白胨1 g/L、NaCl 5 g/L、琼脂粉20 g/L,根据用途加入50 mg/L氨苄青霉素或者卡那霉素。
摇瓶种子培养基:葡萄糖20 g/L、木糖1 g/L、酵母粉5 g/L、蛋白胨1 g/L、NaCl 5 g/L、氨苄青霉素50 mg/L。
摇瓶发酵培养基:葡萄糖20 g/L、木糖20 g/L、酵母粉5 g/L。
1.2 方法
1.2.1 将xylI基因克隆到载体pET28a(+)。
(1)以质粒pAGI02作为模板,采用引物pET28a(+)-xylI(AR)-p1和pET28a(+)-xylI(AR)-p2扩增出理论长度为1 016 bp的xylI核酸序列。
(2)以pET28a(+)作为模版,采用反向引物pET28a(+)-p-F-P1和pET28a(+)-p-F-P2将pET28a(+)线性化,得到理论长度为5 000 bp的核酸序列。
(3)采用T5外切酶[13]的方法处理xylI核酸序列和pET28a(+)线性化的核酸序列,处理后的产物用氯化钙法转化至大肠杆菌DH5α感受态细胞中,30 ℃ 150 r/min复苏40 min后取100 μL菌液涂布于卡那抗性平板上,待卡那抗性平板上长出单菌落后,挑取单菌落提取重组质粒送至生工生物工程(上海)股份有限公司武汉分公司测序,将测序无误的重组质粒命名为pET28a(+)-xylI。
(4)将重组质粒pET28a(+)-xylI采用氯化钙法转化到E.coli BL21中,得到菌株BL21/pET28a(+)-xylI。
1.2.2 将xylI基因克隆到载体pBR322。
(1)以质粒pBR322作为模版,采用反向引物pBR322-F-P1和pBR322-F-P2将pBR322线性化(线性化序列为除去tetP和Tcr部分的序列),得到理论长度为3 094 bp的核酸序列。
(2)以pWYZ-1质粒作为模版,设计引物pBR322-lacP-xylI P1和pBR322-lacP-xylI P2,从pWYZ-1质粒上扩增出lacP-xylI核酸序列,大小为1 168 bp。
(3)用T5外切酶的方法[13]处理lacP-xylI核酸序列和pBR322载体线性化的核酸序列,处理后的产物用氯化钙法转化至大肠杆菌DH5α感受态细胞中,30 ℃150 r/min复苏40 min后取100 μL菌液涂布于氨苄抗性平板上,待氨苄抗性平板上长出单菌落后,挑取单菌落提取重组质粒送至生工生物工程(上海)股份有限公司武汉分公司测序,将测序无误的重组质粒命名为pWYZ-2。