不同生物药剂防治葡萄霜霉病菌的室内毒力测定
作者: 杨波 姜彩鸽 宋双 张华普 张怡
摘要 [目的] 筛选对葡萄霜霉病防效最佳的生物药剂。[方法]选择0.3%丁子香酚、0.3%苦参碱、10%多抗霉素等9种生物药剂开展葡萄霜霉病菌的室内毒力测定。[结果]供试药剂对孢子囊萌发抑制效果最好的是0.3%苦参碱,其EC50值和EC90值分别为2.183 4和0.546 4 mg/L,其次是0.3%丁子香酚;而在葡萄霜霉病预防和治疗的毒力测定中,预防和治疗效果最好的药剂是0.3%丁子香酚,其次药剂效果较好的为0.3%苦参碱。[结论] 0.3%丁子香酚和0.3%苦参碱可作为生物药剂防治葡萄霜霉病。
关键词 葡萄;葡萄霜霉病;生物药剂;毒力测定
中图分类号 S 436.631.1 文献标识码 A 文章编号 0517-6611(2022)01-0137-04
doi:10.3969/j.issn.0517-6611.2022.01.036
Toxicity Determination of Different Biological Fungicides for Controlling Grape Downy Mildew in Laboratory
YANG Bo1,2, JIANG Cai-ge1, SONG Shuang1 et al
(1. Institute of Plant Protection,Ningxia Academy of Agriculture and Forestry Sciences,Yinchuan, Ningxia 750002;2.Ningxia Agricultural Reclamation, Agriculture, Forestry and Animal Husbandry Technology Extension Service Center,Yinchuan, Ningxia 750021)
Abstract [Objective]To select the best biological fungicides for controlling grape downy mildew. [Method]The indoor toxicity determination of grape downy mildew were used to compare 9 kinds of biological fungicides, including 0.3% Eugenol, 0.3% Matrine and 10% Polyoxin. [Result]0.3% matrine had the best inhibition effect on sporangium germination, its EC50 and EC90 values were 2.183 4 and 0.546 4 mg/L respectively, followed by 0.3% Eugenol. In the toxicity test of grape downy mildew prevention and treatment, 0.3% Eugenol had the best prevention and treatment effect, followed by 0.3% Matrine. [Conclusion] The 0.3% Eugenol and 0.3% Matrine can be used as biological agents to control grape downy mildew.
Key words Vitis vinifera;Grape downy mildew;Biological fungicide;Toxicity determination
基金项目 宁夏自治区重点研发计划“宁夏酿酒葡萄病虫害绿色防控关键技术创新与示范”(2019BBF02013);宁夏回族自治区农业科技自主创新资金“农业高质量发展和生态保护科技创新示范项目”(NGSB-2021-4-04)。
作者简介 杨波(1992—),男,宁夏中卫人,助理农艺师,硕士,从事植物保护研究。通信作者,研究员,硕士,从事酿酒葡萄病虫害防治技术研究。
收稿日期 2021-04-15
宁夏回族自治区贺兰山东麓因日照充足、热量丰沛、降雨稀少、昼夜温差大等气候特点,被业界公认为葡萄种植的“黄金地带”[1],截至目前,贺兰山东麓葡萄种植面积达4万hm2[2]。随着葡萄种植面积的不断增加,葡萄生产中病虫害的发生危害也日益加重,尤其是由葡萄霜霉菌[Plasmopara viticola(Berk.dt Curtis)Berl.Et de Toni]引起的霜霉病[3],该病害在严重发生时,叶片呈焦枯状早落,枝梢扭曲畸形,幼果表面布满白色的霉层、皱缩脱落,严重影响葡萄的生长发育以及果实的品质和产量[4-6],轻则减产5%~10%,重则可达60%以上[7],对葡萄产业造成重大的经济损失,已成为制约葡萄产业高质量发展的重要病害。
葡萄霜霉病的综合防治中,药剂防治是最及时高效的防治措施,也是目前葡萄生产中最主要的方法。而随着化学药剂在田间的大量使用,药剂的抗药性问题也在日益增长,研究表明葡萄霜霉病菌已对甲霜灵、杀毒矾、乙磷铝等药剂产生了不同程度的抗药性[8-10];有些化学药剂毒副作用相对较大,药害、污染等问题突出,已不能适应现代葡萄产业绿色健康发展的需求,筛选安全高效环保的杀菌剂是葡萄生产中的迫切需求。随着人民物质生活的日益改善,对无公害、绿色健康农产品的需求日益迫切,为适应当代农业结构性调整,确保农业可持续、高质量发展,必须重视葡萄霜霉病的药剂防治工作。近些年,生物制剂防治葡萄霜霉病成为研究的热点,根据相关研究也筛选出了一些对葡萄霜霉病有效的生物制剂[11-13],但对于宁夏葡萄产业而言,防治霜霉病的药剂仍相对单一,且化学药剂居多,生物药剂防治葡萄霜霉病研究明显不足,是制约该地区葡萄产业绿色、健康、高质量、可持续发展的瓶颈。
笔者选取了9种生物型药剂,对宁夏贺兰山东麓葡萄霜霉病进行室内药剂毒力测定试验,通过评价其室内防治效果,为田间药效评价、生产中科学安全合理防治葡萄霜霉病提供理论依据。
1 材料与方法
1.1 试验药剂
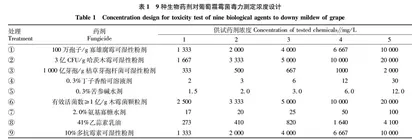
2.0%氨基寡糖水剂(大连凯飞化学股份有限公司),0.3%苦参碱水剂(桂林集琦生化有限公司),0.3%丁子香酚可溶液剂(南通神雨绿色药业有限公司),1 000亿芽孢/g枯草芽孢杆菌可湿性粉剂(德强生物股份有限公司),10%多抗霉素可湿性粉剂(日本科研制药株式会社),100万孢子/g寡雄腐霉可湿性粉剂(捷克生物制剂股份有限公司),3亿CFU/g哈茨木霉可湿性粉剂(美国拜沃股份有限公司),41%乙蒜素乳油(大连木春农药厂有限公司),有效活菌数≥1亿/g木霉菌颗粒剂(上海大井生物工程有限公司)。
1.2 试验方法
1.2.1 菌株采集。
菌株采集于宁夏回族自治区银川市西夏区园林场阳光玫瑰品种上自然发病的新鲜葡萄霜霉病样。
1.2.2 预试验。
将杀菌剂设3个浓度梯度,分别为“<推荐稀释倍数”“推荐稀释倍数”“>推荐稀释倍数”,根据结果进行浓度梯度调整,最终以5个浓度梯度作为正式试验,用以进行病菌对药剂的敏感性判断。同时设清水对照。9种生物药剂对葡萄霜霉菌毒力测定浓度设计见表1。
孢子悬浮液准备:取田间自然发病的新鲜葡萄病叶,用自来水冲洗净表面的孢子后,将病叶置于25 ℃条件下保湿24 h来培养新鲜的孢子;用干净的毛笔将新鲜孢子刷于无菌蒸馏水中,配成孢子悬浮液;在显微镜下调整孢子悬浮液浓度至5×105个/mL用于试验测定,于4 ℃冰箱15 min低温处理后用于接种。
1.2.3 孢子囊萌发测定。
杀菌剂溶液和孢子囊悬浮液的混合:稀释孢子悬浮液,用凹玻片取一滴(20 μL)在显微镜下观察,视野中有70~100个孢子囊时,备用。取PCR板,每孔均加入20 μL制作好的孢子囊悬浮液,再分别加入20 μL不同浓度的药液,每种杀菌剂的每个浓度重复3次,以灭菌水作对照。用硅胶板盖好,放入25 ℃恒温培养箱中。
孢子囊萌发情况的观察和记载:每隔一段时间观察灭菌水对照组中的孢子萌发率,当萌发率达60%~70%则可开始观察试验组萌发率。具体方法:取20 μL混合溶液于凹玻片中,在显微镜下观察,随机观察4个视野中孢子囊的萌发情况,用EVOS数码大屏幕倒置显微镜拍照保存,统计每视野中的孢子囊总数以及萌发数。
1.2.4 离体叶片培养。
选取新生枝条上第3~5节新鲜、长势健康的叶片,分别进行预防作用和治疗作用的测定。每种浓度设3个重复,每个重复3个叶片(即1个药剂需5个浓度×3个重复×3个叶片=45片叶,清水对照另设)(可以1个重复的3个叶片置于一个铺有湿润滤纸的大培养皿内,或者同一个浓度9个叶片置于一个铺有4层湿润纱布的大瓷盘中,培养时覆盖保鲜膜保湿)。
预防作用:将葡萄新枝条上健康无病的4~5位叶片用微型喷雾器喷洒同等量不同浓度药液后自然晾干,放入铺有滤纸的大培养皿中,分别喷施同等量的5×105个/mL的孢子悬浮液,用沾有灭菌水的棉花包裹叶柄保湿,置于生物培养箱中培养,培养条件为温度25 ℃、湿度保持在80%左右、光照12 h/d。对照叶片喷施等量清水晾干,再喷施等量孢子悬浮液。5~7 d 后调查各重复发病情况。注意每1~2 d湿润包裹棉花及滤纸。
治疗作用:将新鲜、干净叶片用沾有灭菌水的棉花包裹叶柄保湿,分别喷施同等量的5×105个/mL的孢子悬浮液,放入铺有滤纸的大培养皿中,置于生物培养箱中培养,培养条件为温度25 ℃、湿度保持在80%左右、光照12 h/d;培养24 h后分别喷洒同等量不同浓度药液,继续培养,5~7 d后调查各重复发病情况。注意每1~2 d湿润包裹棉花及滤纸。
调查方法:根据产孢面积占整个叶盘面积的百分比划分病级。0级,无病;1级,1%~5%;3级,6%~25%;5级,26%~50%;7级,51%~75%;9级,75%以上。
1.3 数据处理
孢子囊萌发抑制率=(对照萌发率-处理萌发率)/对照萌发率×100%
病情指数=[∑(各级病叶数×相对级数值)/(调查总叶数×9)]×100
抑菌率=(对照病情指数-处理病情指数)/对照病情指数×100%
根据上述公式计算病情指数、抑菌率及孢子囊萌发抑制率,然后利用DPS数据处理软件,将相对抑菌率/孢子囊萌发抑制率换算成概率值,在Excel软件中根据药剂系列浓度的对数值及该浓度下相对抑菌率的概率值建立线性回归分析,求出药剂对葡萄霜霉病菌的毒力回归方程、相关系数及有效抑制浓度(EC50)等。
2 结果与分析
2.1 不同生物药剂对葡萄霜霉病孢子囊萌发的毒力测定
由表2可知,不同生物药剂对葡萄霜霉病孢子囊萌发的毒力不同,药剂EC50值是用来衡量药剂间毒力大小的重要指标,EC50值越小,即该药剂对病菌的反应越灵敏,其抑制作用越强,反之抑制作用越差。供试9种生物药剂对葡萄霜霉病孢子囊萌发的敏感性存在一定差异。各药剂对葡萄霜霉病孢子囊萌发的敏感性由大到小依次为0.3%苦参碱水剂>0.3%丁子香酚可溶液剂>10%多抗霉素可湿性粉剂>1 000亿芽孢/g枯草芽孢杆菌可湿性粉剂>2.0%氨基寡糖水剂>100万孢子/g寡雄腐霉可湿性粉剂>41%乙蒜素乳油>有效活菌数≥1亿/g木霉菌颗粒剂>3亿CFU/g哈茨木霉可湿性粉剂,其中0.3%苦参碱水剂和0.3%丁子香酚可溶液剂2种药剂对葡萄霜霉病孢子囊的敏感性最高,EC50分别为2.183 4和5.725 6 mg/L,EC90分别为0.546 4和0.377 5 mg/L。