农村生活污水贝类净化区细菌群落结构解析
作者: 高娜 梁阳阳 李静 杨坤 方婷 赵秀侠 崔凯 卢文轩
摘要 [目的]研究农村生活污水贝类净化区的细菌群落结构。[方法]采用Illumina-MiSeq高通量测序技术对贝类处理单元水体及贝类样品进行细菌多样性分析。[结果]贝类样品中的细菌群落多样性和丰度均显著高于处理单元水体。4组样品中均有大量序列不能被归入已知的属,在门的分类水平上,优势菌门是蓝细菌门(Cyanobacteria)和放线菌门(Actinobacteriota);在属水平上,优势细菌属主要为Cyanobium_PCC_6307、hgc I_clade。菌群分析发现贝类处理单元水体可能处于富营养化进程中。水质检测分析发现贝类通过滤食作用对氨氮、总磷和COD的去除率分别达到39.75%、37.21%、59.52%。[结论]该研究为贝类净水技术提供基础数据,对贝类处理农村生活污水系统的构建具有指导意义。
关键词 农村生活污水;淡水贝类;净化区;高通量测序;群落结构;细菌多样性
中图分类号 X 703 文献标识码 A 文章编号 0517-6611(2022)09-0083-04
doi:10.3969/j.issn.0517-6611.2022.09.020
开放科学(资源服务)标识码(OSID):
Analysis of Bacterial Community Structure in Shellfish Purification Area of Rural Domestic Sewage
GAO Na, LIANG Yang-yang, LI Jing et al
(Fisheries Research Institute, Anhui Academy of Agricultural Sciences, Key Laboratory of Freshwater Aquaculture and Enhancement of Anhui Province, Hefei,Anhui 230000)
Abstract [Objective]To study the microbial community composition in shellfish purification area of rural domestic sewage.[Method]The Illumina-MiSeq high-throughput sequencing technology was used to analyze bacterial diversity in shellfish treatment unit water and shellfish samples. [Result]The diversity and abundance of bacterial community in the shellfish samples were significantly higher than those in the water of the treatment unit.There were a large number of sequences in the four samples that cannot be classified into known genera.The dominant bacteria were Cyanobacteria and Actinobacteriota at phylum level. At the genus level, the mainly bacteria are CyanobiumPCC6307 and hgc Iclade. Microbiota analysis showed that the water of the shellfish treatment unit may be in the process of eutrophication. Water quality detection and analysis showed that the removal rates of ammonia nitrogen, total phosphorus and COD by shellfish filter-feeding were 39.75%, 37.21% and 59.52%, respectively. [Conclusion]The research provides a theoretical basis for shellfish water purification technology, and it has guiding significance to the construction of shellfish treatment rural sewage system.
Key words Rural domestic sewage;Freshwater shellfish;Purification area;High-throughput sequencing;Community structure;Bacteria diversity
随着我国农村工业化和城市化进程的加快,环境污染已从城市迅速扩散到农村地区,其中水体污染在农村环境污染中尤为突出[1]。安徽省第二次全国污染源普查结果显示,2017年农村生活污水COD、NH3-N、TP、TN排放量分别占生活源排放总量的44.4%、38.1%、39.6%、33.5%;然而生活污水中各污染物有效治理率均在6%以下,排放后造成地表水与地下水的严重污染[2]。由于地域和经济水平差异的原因,农村生活污水的处理模式也多种多样。目前较常规的处理技术主要有人工工艺处理系统(如生物滤池、化粪池、氧化沟等生态组合工艺)、自然生态处理工艺系统(如生物稳定塘、人工湿地、土地渗滤等)[3]。然而现有处理设施的处理能力及管网建设仍然存在着一些不足,因此有必要寻找一种建设成本较低且易于维护的工艺来改善农村水污染的现状。
芜湖水韵环保公司发明了一种以淡水贝类为主导的农村生活污水资源化利用处理模式,包括依次连接的收集池、厌氧预处理池和生产型湿地,湿地中以淡水贝类(蚌和螺)为主要物种,通过搭建支架结构平台,形成贝床的立体空间结构,有效保证贝类在空间上的数量、密度、存活量,实现上中下层水体的同步净化。同时搭配鱼类和植物,形成共生体系,共同利用水体中的氮磷等营养物质,达到水质净化及资源利用的目的。
已有研究表明,贝类通过过滤水体,在一定程度上能有效控制水体富营养化,达到改善水质的目的[4]。笔者以芜湖市湾沚区陶辛镇水系连通及农业面源污染治理示范工程为对象,研究贝类净化区的运行效能以及各级贝床系统中的细菌群落结构特征。
1 材料与方法
1.1 贝床处理技术
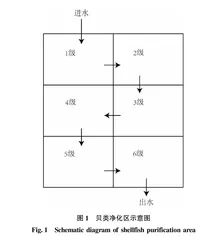
水系连通及农业面源污染治理贝类净化区示意图如图1所示,根据进水水质和水质目标,核算贝床面积,结合现场用地,设计了6级串联贝床处理单元以构建贝床处理系统,同时搭配螺类、鱼类和草类,逐级净化污水。
1.2 样品采集
2021年5月中旬进行样品采集,分别在1级(L1)、3级(L3)、6级(L6)处理单元中各采集3个重复样品。每个点取500 mL污水装入无菌PV瓶,低温条件下保存运输至实验室。用孔径为0.22 μm的硝酸纤维素滤膜过滤收集水体中的细菌,将过滤好的滤膜保存在灭菌的1.5 mL离心管中,-20 ℃保存用于细菌基因组DNA的提取。由于贝类在滤食饵料生物的同时会在体内富集一定的细菌,而且贝类的外壳也可以作为细菌生物膜的附着基质。因此该研究也对贝类附着的细菌进行了分析,分别从各级处理系统中采集一定的贝类样品,加入无菌水,超声波洗脱贝类富集的细菌,命名为BM。
1.3 水质检测
为考察双壳贝类的净化作用,分别测定1级、3级、6级处理单元的水质参数,包括总氮(TN)、化学需氧量(COD)、氨氮(NH4+-N)、硝态氮(NO3--N)和亚硝态氮(NO2--N)。TN采用碱性过硫酸钾消解紫外分光光度法(GB 11894—89)测定,COD采用快速消解分光光度法(HJ/T 399—2007)测定,氨氮采用《水质氨氮的测定纳氏试剂分光光度法》(HJ 535—2009)测定,硝态氮采用紫外分光光度法(HZ-HJ-SZ-0138)测定,亚硝酸氮采用盐酸萘乙二胺分光光度法测定。
1.4 细菌菌群分析
将采集的样品送至上海美吉生物医药有限公司进行DNA提取,PCR扩增采用细菌16S rDNA V3-V4区的通用引物338F/806R[5]。测序得到的原始序列通过拼接、过滤、去除非特异性扩增序列及嵌合体后得到有效序列[6]。利用QIIEME软件将相似度>97%的序列定义为一个操作分类单元(OTU),利用SILVA数据库对OTUs进行注释[7]。利用Mothur软件计算Alpha多样性指数,多样性分析中Chao 1指数和ACE指数用来估计菌群丰度,香农指数(Shannon index)和辛普森指数(Simpson index)显示菌群的多样性,覆盖率用来表征测序深度。
2 结果与分析
2.1 贝类净化区的运行效能分析
1级、3级、6级贝类处理单元的水质参数如表1所示,与前人的研究结果一致[4,8],贝类通过其强大的滤水滤食功能,可以有效地去除水体中的氮磷。生活污水经过贝类净化后,氨氮、总磷、COD的去除率分别达到39.75%、37.21%、59.52%,且净化后水体水质达到《地表水环境质量标准》(GB 3838—2002)中的Ⅳ类水标准及以上。
2.2 高通量序列丰度及OTU分析
对测序所得的序列进行拼接、质控、去除低质量序列和嵌合体,12个样本共获得504 846条合格的16S rDNA序列,每个样本的有效序列数目在37 624~48 125条。通过对97%相似度的OTU进行稀释性曲线分析,结果发现(图2),各个样本曲线均趋向平坦,说明测序数据量合理,更多的数据量只会产生少量新的OTU,因此测序所得序列能够完全展示样品细菌群落多样性。为进一步探究每个样本中细菌多样性的相互关系,通过维恩分析观察水体和贝类样本的OTU数目组成相似性及重叠情况[9]。4组样品共有的OTU数目为286,不同样品中特有OTU表现为1级处理单元53个、3级处理单元25个、6级处理单元18个,贝类样本1 038个(图3)。
2.3 α多样性分析
利用测序划分的OTU对不同样品的α多样性进行分析,结果如表2所示,从表2可以看出,4组样品的多样性测序结果覆盖度均高于99%,表明测序结果覆盖度较好且具有很高的可信度。Chao 1和ACE指数反映群落分布丰度,指数越大,丰度越高;Shannon指数和Simpson指数反映群落分布多样性,Shannon指数越大、Simpson指数越小,说明群落多样性越高。贝类样本(BM)的Shannon指数、Chao 1指数和ACE指数都明显高于不同处理单元水体样本,说明贝类附着细菌的群落多样性和丰度均高于水体样本。有研究表明水体理化参数是影响污水处理系统中微生物群落结构的重要环境因子[10],6级(L6)处理单元中水质进一步改善,Chao 1指数和Shannon指数均最小,表明其中的细菌丰度和群落多样性都处于最低水平。
2.4 各样本细菌菌群组成
所有样本序列分属37个门,丰度占比均小于0.01的物种归为others。从各样本中细菌群落结构组成(图4)可以看出,主要的门类为蓝细菌门(Cyanobacteria)、放线菌门(Actinobacteriota)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidota)、厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobia)、绿弯菌门(Chloroflexi)等,这些均为典型淡水细菌门类,与其他水体微生物群落结构的研究结果相似[11-12]。蓝细菌门为第一大门类,所占比例为15.22%~57.99%。1级(L1)和3级(L3)处理单元水体中细菌群落的组成和丰度基本相似。放线菌门(Actinobacteriota)是1级处理单元水体中的第一优势门,占比34.11%,第二优势门为蓝细菌门,占比26.09%。3级处理单元水体中第一优势门为蓝细菌门(Cyanobacteria),占比33.71%。蓝细菌门在6级(L6)处理单元水体中处于绝对优势地位,占比高达57.99%。蓝细菌作为水生态环境的指示物种,其大量分布说明水体可能处在富营养化进程中[13]。贝类样品(BM)中第一优势门为变形菌门(Proteobacteria),占比40.63%,且贝类样品中厚壁菌门(Firmicutes)和Deinococcota的占比明显高于处理单元水体。