直播稻金粳818成熟胚遗传转化体系的建立
作者: 李军玲 张红磊 张融雪 蔡昱萌 汪颖 佟卉 刘燕清 苏京平
摘要 [目的]建立高效的金粳818成熟胚遗传转化体系。[方法]以直播稻品种金粳818成熟胚为外植体,设计4种诱导培养基,筛选适合金粳818的诱导条件;设计5种分化培养基,筛选适合金粳818的分化条件;获得的愈伤组织用农杆菌介导法进行转基因再生。[结果]最佳诱导培养基为4.10 g/L NB+2 mg/L 2,4-D,诱导率为89.3%;最佳分化培养基为MS+5.0 mg/L KT+0.5 mg/L NAA,分化率为81.1%,成苗率为52.1%;经PCR分子检测,再生幼苗100%为转基因阳性植株。[结论]该研究建立了金粳818成熟胚遗传转化体系,为品种定向改良奠定了技术基础。
关键词 金粳818;成熟胚;愈伤组织;遗传转化
中图分类号 S 511 文献标识码 A 文章编号 0517-6611(2022)09-0100-04
doi:10.3969/j.issn.0517-6611.2022.09.024
开放科学(资源服务)标识码(OSID):
Establishment of Genetic Transformation System of Mature Embryo of Direct Seeding Japonica Rice Variety Jingeng 818
LI Jun-ling, ZHANG Hong-lei, ZHANG Rong-xue et al
(Crop Research Institute, Tianjin Academy of Agricultural Sciences, Tianjin Key Laboratory of Crop Genetics and Breeding, Tianjin 300384)
Abstract [Objective]To establish an efficient genetic transformation system of Jingeng 818. [Method]Using the mature embryo of direct seeding rice variety Jingeng 818 as explant, four induction medium schemes were designed to obtain the suitable induction conditions of Jingeng 818;five kinds of differentiation medium were designed to obtain the suitable differentiation condition for Jingeng 818; and the obtained callus was used to establish the transgenic regeneration system by agrobacterium mediated method. [Result]The results showed that the best induction medium was 4.10 g/L NB+2 mg/L 2,4-D with the induction rate 89.3%. The best differentiation medium was MS+5.0 mg/L KT + 0.5 mg/L NAA with the differentiation rate 82.1% and the seedling rate 52.1%. By PCR molecular detection, 100% of the regenerated seedlings were transgenic positive plants.[Conclusion] In this study, the genetic transformation system of mature embryo of Jingeng 818 was established, which laid a technical foundation for directional improvement of varieties.
Key words Jingeng 818;Mature embryo;Callus;Genetic transformation
水稻是我国第一大口粮作物,水稻生产事关国家口粮安全。稻田杂草防除是生产中的棘手问题,由于禾本科杂草、杂草稻等与水稻亲缘关系较近,常规除草剂对其无效,培育具有除草剂抗性水稻品种能较好地解决稻田草害问题。金粳818是天津市水稻研究所选育的具有除草剂抗性的粳型常规水稻品种,为采用生物技术手段对金粳818进行改良而培育的新种质,可为除草剂抗性水稻提供新材料,其遗传转化体系的建立尤为重要。
利用愈伤组织再生体系进行水稻遗传转化是最广泛应用的方法之一,具有明显优点,如外植体来源广泛、周期短、易于转化、转化效率高等[1];农杆菌介导法是水稻遗传转化首选方法,具有易操作、低拷贝、基因沉默少、遗传稳定等诸多优势[2]。相比籼稻而言,粳稻愈伤诱导率和分化再生率较高,不少粳稻品种的组织培养再生体系已经建立且转基因体系成熟,如日本晴、中花11、秀水134等[3-7]。影响水稻愈伤组织诱导率、分化率和再生率的主要因素是基因型[8],而品种间基因型的差异导致尚缺乏统一的配方适合所有品种。笔者以成熟胚为外植体,设计了4种不同诱导培养基摸索适宜诱导条件,设计5种分化培养基,利用获得的愈伤组织以农杆菌介导法进行转基因再生,建立高效的金粳818成熟胚遗传转化体系,为利用生物技术定向改良奠定基础。
1 材料与方法
1.1 材料
以天津市水稻研究所自主育成的金粳818成熟胚为外植体。含有pCAMBIA1301质粒的EHA105农杆菌由天津市农作物遗传育种重点实验室保存。培养基NB(货号N492)和MS(货号M519)及激素均购自Phytotechnology。
1.2 培养基
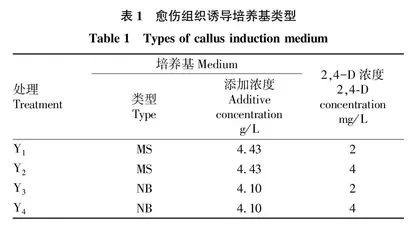
1.2.1 诱导培养基。基础培养基+0.5 g/L L-脯氨酸+0.5 g/L谷氨酰胺+0.3 g/L水解酪蛋白+30 g/L蔗糖+3.5 g/L 植物凝胶+2,4-D(表1),调节pH为5.8。
1.2.2 筛选培养基。4.1 g/L NB+0.5 g/L L-脯氨酸+0.5 g/L谷氨酰胺+0.3 g/L 水解酪蛋白+30 g/L蔗糖+3.5 g/L 植物凝胶+2 mg/L 2,4-D+40 μg/L潮霉素+400 μg/L青霉素,调节pH为5.8。
1.2.3 分化培养基。4.43 g/L MS+0.5 g/L L-脯氨酸+0.5 g/L谷氨酰胺+0.3 g/L 水解酪蛋白+0.1 g/L 肌醇+30 g/L 山梨醇+30 g/L蔗糖+3.5 g/L 植物凝胶+30 μg/L潮霉素+300 μg/L青霉素+不同激素组合(表2),调节pH为5.8。
1.2.4 生根培养基。2.215 g/L MS+30 g/L蔗糖+3.5 g/L植物凝胶+20 μg/L潮霉素+200 μg/L青霉素,调节pH为5.8。
1.2.5 AAM侵染液。4.1 g/L NB+68 g/L蔗糖+36 g/L 葡萄糖+0.5 g/L水解酪蛋白+0.5 g/L L-脯氨酸+0.5 g/L L-谷氨酰胺+177 mg/L L-精氨酸+7.5 mg/L甘氨酸+300 mg/L L-天冬氨酸+2.5 mg/L 2,4-D,调节pH为5.2,使用前加入0.5 mL浓度为20 mg/L乙酰丁香酮。
1.3 方法
1.3.1 金粳818成熟胚愈伤组织诱导。收取当年新的金粳818成熟种子,剥离颖壳,取适量倒入50 mL离心管中,75%乙醇消毒1 min,30%次氯酸钠(有效氯3%)消毒15 min,无菌水冲洗5~6次,去除多余水分,倒入铺有3层灭菌滤纸的培养皿中,无菌风吹干15 min。最后接种到诱导培养基中,每皿25~35粒种子,28 ℃暗培养10 d,在水稻幼芽和成熟胚之间长出淡黄色、结构致密的胚性愈伤组织,掐芽剥离出愈伤后放入新的诱导培养基上3~5 d即可进行转化,诱导10 d后统计诱导率。
诱导率=出愈伤的成熟胚数量/总成熟胚数量×100%
1.3.2
农杆菌培养及浸染。将含有pCAMBIA1301质粒的农杆菌EHA105在YEP(含25 mg/L卡那霉素)固体平板上划线,28 ℃培养2 d。刮取平板上的农杆菌至AAM浸染液中,调整菌体浓度至OD600值为0.3~0.5,获得农杆菌悬浮液。挑取足够数量的愈伤组织放入无菌三角瓶中,加入农杆菌悬浮液,室温放置浸染20 min,并间隔晃动几次,倒掉菌液,将愈伤组织放置无菌滤纸上吸去多余菌液,转移至铺有一层无菌滤纸的固体培养基上,26 ℃黑暗培养3 d。
1.3.3 筛选培养。培养3 d后的愈伤组织,用无菌水清洗2次,用含有500 μg/mL羧苄青霉素的无菌水冲洗1次,吸去多余水分后将愈伤组织转移到无菌滤纸上,晾干,转移至筛选培养基上进行筛选培养,28 ℃,暗培养30 d。
1.3.4 分化再生。筛选30 d后,在原愈伤的底部可见颜色淡黄、结构致密、直径1~2 mm的阳性愈伤长出,挑取阳性愈伤到分化培养基上进行分化再生,培养条件为28 ℃,16 h光照/8 h黑暗培养。15~20 d统计分化率,25~35 d统计成苗率。
分化率=分化的愈伤组织数量/总愈伤组织数量×100%
成苗率=分化的幼苗数量/分化的愈伤组织数量×100%
1.3.5 生根培养及驯化。分化出的幼苗长到2~3 cm有明显根系时,转移到生根培养基上,培养条件28 ℃,16 h光照/8 h黑暗培养。7~10 d后,幼苗长出大量侧根,当小苗长至高10~15 cm时,打开盖子在室外炼苗2~3 d,取出小苗后洗去根部培养基,移栽至土中。
1.3.6 转基因植株鉴定。CTAB法提取幼苗DNA,并用潮霉素基因引物检测植株。
hygF:ACGGTGTCGTCCATCACAGTTTGCC
hygR:TTCCGGAAGTGCTTGACATTGGGGA
2 结果与分析
2.1 培养基和2,4-D浓度对愈伤组织诱导的影响
共设计4组诱导培养基,包含2种类型基础培养基和2种浓度2,4-D。试验结果表明,同一激素浓度下,NB培养基的诱导率高于MS培养基的诱导率,即Y3>Y1,Y4>Y2,且愈伤组织状态更好,无明显根毛,芽较短。同一基础培养基条件下,4和2 mg/L 2,4-D对愈伤诱导率差别不大。综上,适宜的诱导培养基为Y3( 4.10 g/L NB+2 mg/L 2,4-D),诱导率为89.3%,且愈伤状态良好(表3和图1)。
2.2 不同浓度KT对愈伤组织分化再生的影响
设计了5种不同KT浓度分化培养基,金粳818愈伤组织在不同KT浓度分化培养基中分化成苗差异明显。试验数据表明,同一浓度NAA条件下,一定范围内KT浓度越高,分化率和成苗率越高,表现为F4>F3>F2>F1,KT浓度升高至6 mg/L,其分化率和成苗率反而有所下降。分化21 d时,F4处理绿点数量最多,个别愈伤组织分化出小苗(图2)。因此,适宜分化培养基激素配比为F4处理,即5 mg/L KT+0.5 mg/L NAA,可使分化率和成苗率分别达到81.1%和52.1%(表4)。