苦草立体种植对湖泊水体的影响
作者: 高子昕 刘兴国
摘要[目的]研究苦草立体种植对湖泊水体的影响。[方法]针对湖泊深水区沉水植物难以生长的难题,设计了一种苦草立体种植伐架并开展了种植试验,对苦草立体定植区主要水质指标和浮游生物群落等进行分析。[结果]立体定植苦草30 d可使周边水体中氮、磷、COD下降,并可显著抑制蓝藻生长,使硅藻成为优势种。水体的流动性和水域面积对苦草水体修复效果有显著的影响作用,但在9、10月份苦草枯萎季节应打捞枯萎死亡的苦草,避免苦草衰败期带来的二次富营养化影响。[结论]立体种植苦草可以有效净化氮磷营养物,改善水域生态环境,是一种有效的深水水体修复方法。
关键词苦草;立体种植;湖泊修复;营养盐;浮游生物
中图分类号X524文献标识码A
文章编号0517-6611(2022)13-0082-05
doi:10.3969/j.issn.0517-6611.2022.13.022
Effects of Stereoscopic Planting of Vallisneria natans on Lake Water
GAO Zi-xin LIU Xing-guo
(1.Institute of Fishery Machinery and Instruments, Chinese Academy of Fisheries Sciences, Shanghai 200092;2. School of Fisheries and Life Technology, Shanghai Ocean University,Shanghai 201306)
Abstract[Objective]To study the effect of stereoscopic planting of Vallisneria natans on lake water.[Method] Aiming at the difficulty of submerged plant growth in the deep water area of lake,a stereoscopic planting frame for Vallisneria planting was designed and planting experiments were carried out to analyze the main water quality indicators and plankton community in the stereoscopic colonization area of Vallisneria natans.[Result]Stereoscopic planting of Vallisneria natans for 30 days could reduce nitrogen, phosphorus and COD in the surrounding water, and could significantly inhibit the growth of cyanobacteria, making diatoms the dominant species.Water flow and water area had a significant effect on the restoration effect of Vallisneria natans,but the withered and dead bitter grass should be salvaged in September and October during the Vallisneria natans withering season to avoid the secondary eutrophication caused by the Vallisneria natans decay period.[Conclusion] Stereoscopic planting of Vallisneria natans can effectively purify nitrogen and phosphorus nutrients and improve the ecological environment of waters. It is an effective deep water restoration method.
Key wordsVallisneria natans;Stereoscopic planting;Lake restoration;Nutrients;Plankton
苦草(Vallisneria natans)是常见的沉水植物之一,广泛分布于我国南北各省区,在淡水湖泊、沟渠、池塘、内河航道的静水或流动水体中均能很好的生长[1]。苦草生态适应性广,能进行克隆生长,再生能力强,群落破坏后恢复时间短,吸附污染物能力强,是减少水体污染,缓解水体富营养化程度的重要沉水植物之一[2]。德国曾采用苦草进行生态修复,发现湖泊水体在春季和夏季均能保持良好的水质,不会出现富营养化[3]。我国的武汉东湖[4-5]、杭州西湖[6]、云南异龙湖[7]、河北白洋淀[8]等水体也曾选用苦草作为生态修复沉水植物使水体氮磷减少,水质得到改善。
光照是影响沉水植物生长的主要影响因子之一[9],但由于沉水植物在湖泊底层生长的生存特性,导致许多水域较深,光照无法透底的湖泊无法通过沉水植物治理湖泊。李启升等[10]在水深对沉水植物苦草生长的影响试验中发现,苦草在水深1.5 m时,其相对生长率和生物量最高;Xiao等[11]在梁子湖进行的水深(60~260 cm)模拟试验也发现,水深在100~160 cm时,苦草最适宜生长。赵文婧等[12]在浮床模式下对沉水植物净化水质的研究中发现,苦草的除氮率为49.4%,除磷率为15.0%。因此该研究通过搭建立体定植装置定植苦草,其可以根据光照和透明度人工调节苦草离水面的高度,避免苦草受弱光或者黑暗胁迫,较浮床模式更便捷可控。该研究拟通过分析苦草立体种植水域苦草对水质的影响及试验后浮游生物组成,探索通过该装置控制水下固定的苦草对湖泊水质及生态的实际影响,为沉水植物修复湖泊水质提供一定参考。
1材料与方法
1.1架筏设计试验所在的鲥鯸淀位于白洋淀中南部,东西长约1.2 km,南北宽约1.1 km,水深较浅(1~3 m),水量约为262万m3,其水域相对稳定[13]。
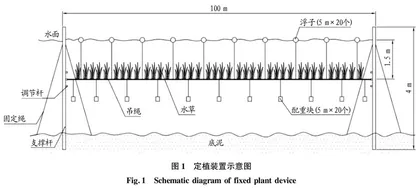
在网围区域靠近预留航道一侧与内部围隔试验区选取鲥鯸淀水流较平缓区域,架设如图1所示的立体种植装置,每个区域设置一个试验组,一组含有4排立体种植装置,每排相间10 m,分别设试验组A(开放型)和试验组B(封闭型),并在试验区外设置采样点作为对照组。立体种植装置主体由钢管和种草绳构成,配有重块、浮子、调节杆等辅助装置。其中,种草绳是运用网眼较小的渔网或拦网绕成直径30~40 mm的粗绳,通过固定苦草根部使苦草可以固定在水下水草的最佳生长深度1.5 m处。
1.2样品采集采样点如图2所示,分别均匀分布在2个试验地点的6个点位,每个采样点均位于两排立体定植装置中间。用10 L的采水器取水下0.5 m处水样,用25号浮游生物网采集浮游生物,并通过鲁格试剂和甲醛溶液固定保存。通过YSI水质分析仪现场测定采样点物理指标。
1.3理化指标测定试验开始后,于2019年7—11月对鲥鯸淀进行采样调查。水质指标总氮(TN)、总磷(TP)、氨氮(NH4+-N)、化学需氧量(COD)、亚硝态氮和硝态氮的测定方法参照《水和废水监测分析方法》(第四版)[14],具体如表1所示。物理指标温度、溶解氧(DO)、盐度、pH通过YSI水质分析仪测量现场测定。
1.4浮游生物测定浮游生物测定分为定量、定性2种,样品采集、浓缩、计数方法参见文献[15]。试验测定并计算浮游生物的优势种、优势度(Y)、Shannon-Weaver多样性指数(H')、Pielou均匀度指数(J)和Margalef丰富度指数(D)。
1.5数据处理采用Excel软件计算其平均值、标准差,并通过Origin 2018作图。采用SPSS软件,通过单因素方差分析法(one-way ANOVA)进行差异性分析。
2结果与分析
2.1主要水质指标变化情况试验开始后,采样点的水温、溶解氧、pH、盐度等水域水体物理指标变化情况如图3所示。由图3可知,2个试验组水温变化趋势一致,没有明显差异,8月份水温达到最高值。试验组的DO含量均在8月份开始有所下降,总体趋势线试验组B普遍大于试验组A。盐度变化稳定,2个试验组采样点之间差异较小,盐度均在8月份最低,随后呈逐月平稳上升趋势。pH在8.03~9.03波动,除了10月份外,试验组B的pH普遍大于试验组A;2个试验组的pH总体趋势是呈下降的,试验组A的pH最高在10月份,试验组B的pH最高在9月份。
2.2水体中氮磷及COD指标变化情况
2.2.1TN。立体种植试验区周边水体TN变化如图4所示,试验开始时,试验组A、试验组B和对照组水体TN的浓度分别为2.03、2.23和1.77 mg/L,30 d后,由于苦草的生长,试验区水体中的TN迅速下降,试验组A、试验组B水体TN比初始值分别下降了49.26%和35.87%,随着时间的变化,试验组水体TN均有所上升,但在10月份到达一个峰值后有所下降,总体11月份试验组水体TN水平未超过7月份,试验组A在11月份的TN浓度比7月份下降了11.33%。
2.2.2TP。从图5可以看出,试验开始时,试验组A、试验组B和对照组水体TP的浓度分别为0.014、0.028和0.090 mg/L。试验开始30 d后,对照组水体TP变化相对稳定,试验组A和试验组B水域的TP含量分别是对照组的25.29%和14.98%,试验组水体TP在试验后的第二个月(9月份)均快速上升,并在10月份基本回归原水平,而后又于11月份极显著上升。其中,试验组A水体TP浓度11月为7月的109.47倍,试验组B水体TP浓度11月为7月的54.58倍。
2.2.3硝态氮。从图6可以看出,试验组A、试验组B和对照组硝态氮初始值分别为0.20、0.21和0.14 mg/L。试验组A、试验组B硝态氮10月份与7月份相比分别增加了583.69%和955.47%;在11月均有显著下降,与7月份相比分别增加了66.65%和244.29%。而对照组硝态氮相对平稳,均在0.26 mg/L以下。
2.2.4NH4+-N。从图7可以看出,试验区周围水中的NH4+-N浓度在试验开始后比对照组低,试验组A、试验组B和对照组水体NH4+-N初始值分别为0.01、0和0.34 mg/L;试验组NH4+-N浓度均在试验开始后上升且在8月份后又下降,于9月份达到试验区NH4+-N浓度的最低值,试验组B于10月份达到NH4+-N浓度的最高值,比8月份增长了53.71%;对照组水体中NH4+-N先上升后下降,9月份达到最高(0.59 mg/L),11月份最低(0.03 mg/L)。
2.2.5亚硝态氮。从图8可以看出,试验开始前,试验组A、试验组B和对照组水体亚硝态氮分别为0.007、0.003和0.003 mg/L,30 d后,试验组水体亚硝态氮浓度均降至近乎不存在。随着时间的变化,试验组水体亚硝态氮有所上升并在10月份达到最大值,11月试验组A的亚硝态氮浓度比7月份下降了40.30%,试验组B的亚硝态氮浓度在11月份也在显著降低。