以β-半乳糖苷酶脂质体为模型筛选冷冻干燥保护剂的新方法
作者: 张寅 王保卫 马婷婷
摘要 [目的]以β-半乳糖苷酶脂质体的直径、分散系数(PDI)和Zeta电位为检测指标,联合透射电子显微镜法,创建一种利用脂质体模拟细胞膜筛选冷冻干燥保护剂的模型,从而快速筛选出瑞士乳杆菌冷冻干燥保护剂,有效提高乳酸菌冻藏菌种的活性。[方法]拟采用800 W功率超声10 min的方法来获取优质β-半乳糖苷酶脂质体,添加不同的冻干保护剂后进行冻存。以冻干脂质体水解后β-半乳糖苷酶渗透率为评价指标,评价冷冻干燥保护剂的保护效果。[结果]海藻糖浓度为100 mg/L、透明质酸浓度为2 mg/L时,β-半乳糖苷酶渗透速率最慢。选取瑞士乳杆菌9(LH-9)对上述结果进行验证,发现冻干保护剂对LH-9有同样的保护作用。[结论]该研究为今后乳酸菌冻干保护剂的筛选研究提供新思路。
关键词 脂质体;β-半乳糖苷酶;冷冻保护剂;真空冷冻干燥;乳杆菌
中图分类号 TS 252 文献标识码 A 文章编号 0517-6611(2022)15-0001-05
doi: 10.3969/j.issn.0517-6611.2022.15.001
开放科学(资源服务)标识码(OSID):
A New Method for Screening Freeze-drying Cryoprotectants Using β-galactosidase Liposomes as a Model
ZHANG Yin, WANG Bao-wei, MA Ting-ting
(Shijiazhuang Institue for Food and Drug Control, Shijiazhuang,Hebei 050000)
Abstract [Objective] Using the diameter, dispersion coefficient (PDI) and Zeta potential of β-galactosidase liposomes as detection indicators, combined with transmission electron microscopy, a model for screening freeze-drying cryoprotectants using liposomes to simulate cell membranes was established, so as to quickly screen out the Lactobacillus helveticus freeze-drying cryoprotectants, which could effectively improve the activity of the frozen-storage strains of lactic acid bacteria.[Method]High-quality β-galactosidase liposomes were obtained by ultrasonic at 800 W power for 10 min, and cryopreserved after adding different cryoprotectants. The protective effect of freeze-dried cryoprotectants was evaluated by the β-galactosidase permeability after hydrolysis of freeze-dried liposomes.[Result] When the trehalose concentration was 100 mg/L and the hyaluronic acid concentration was 2 mg/L, the penetration rate of β-galactosidase was the slowest. Lactobacillus helveticus 9 (LH-9) was selected to verify the above results, and it was found that the lyoprotectant had the same protective effect on LH-9.[Conclusion] This study provides new ideas for the screening of lactic acid bacteria cryoprotectants in the future.
Key words Liposome;β-galactosidase;Cryoprotectant;Freeze-drying;Lactobacillus helveticus
脂质体是一种人工制备的磷脂类生化物质,与细胞膜结构类似,具有典型的双亲分子特性[1-2],亲水性溶质不能轻易穿过磷脂双分子层,所以脂质体经常被视为理想的人工细胞膜模型[3-6]。
真空冷冻干燥法由于其包装、运输以及保存上独特的优点,而成为一种有效的菌株保藏方法[7-8],而且此方法非常适合长期保藏乳制品及食品发酵剂中的乳酸菌(LAB)[9-10]。但是如果不添加冷冻干燥保护剂,冻干保藏的细胞很容易失去其自身的活力。研究表明,若直接对乳酸菌进行冷冻干燥,其死亡率将达90%以上[11]。冷冻干燥造成细胞损伤的原因主要包括冰晶形成、盐浓度升高、活性氧自由基(ROS)增加和细胞膜透性改变等[12-14]。而细胞膜的损伤则被认为是造成细胞在冷冻干燥过程中死亡的主要原因[15]。对于绝大多数菌株来说,冷冻干燥保藏法成功的关键在于有效保护剂的使用[16]。研究证明,一些多糖和双糖(如海藻糖和透明质酸)能够在冷冻干燥时对菌株起到保护作用[17]。冻干保护剂可以改变菌株冷冻干燥时的物理化学环境,减轻或抑制冷冻干燥或复水对细胞膜的损害,保护蛋白的结构及其生理活性,尽可能保持菌株原有的各种生理生化特性和生物活性[18-19]。不同的保护剂有着各自的特点,使用单一的保护剂不足以为菌株提供抵抗外界恶劣环境的条件。因此,在乳酸 菌(LAB)的冷冻干燥保存过程中,复配保护剂的使用效果优于单一保护剂的使用效果[20-23]。但是,目前依然采用极其复杂的方法筛选合适的乳酸菌冷冻干燥保护剂,效率极低,耗费了大量的人力物力。该研究首次提出一种可以快速筛选出最优冷冻干燥保护剂的方法,以便于在冷冻干燥保藏时有效保存LAB发酵剂的活性。试验选取最佳的条件制备脂质体,并以脂质体包埋β-半乳糖苷酶作为细胞膜模型,添加不同的冷冻干燥保护剂,然后对其进行冷冻干燥保存。通过测定β-半乳糖苷酶渗透速度,评价不同冷冻干燥保护剂在冻干条件下对脂质体的保护效果,并选取瑞士乳杆菌9(LH-9)对上述试验结果进行验证,从而确定此快速筛选方法的可行性。
1 材料与方法
1.1 试验材料
1.1.1 试剂。
邻硝基苯β-D-半乳吡喃糖苷(ONPG)、大豆卵磷脂、β-半乳糖苷酶、胆固醇、十八胺,以上试剂均购自Sigma-Aldrich公司(St.Louis,MO);海藻糖、透明质酸(HA)、氯仿、Tris溶液、10×磷酸盐缓冲溶液(PBS),以上试剂均购自Fisher Scientific公司(Pittsburgh,PA);带Formva膜的40目铜网;牛血清白蛋白、葡聚糖凝胶G-200,均为分析纯。
1.1.2 设备。
旋转蒸发器,R-201,上海申顺生物科技有限公司;超声波清洗器,KQ-500E,昆山市超声仪器有限公司;超声波细胞粉碎机,JAC-IV型,济宁市奥波超声波电气有限公司;Zetasizer Nano ZS90激光粒度仪,马尔文帕纳科技公司;TEM-1010透射电子显微镜,日本电子公司;自动液相色谱分离层析仪,MC99-3,上海沪西分析仪器厂有限公司;紫外分光光度计,752SPECTROPHOTOMETER,美谱达仪器;真空冷冻干燥仪,FD-1,北京德天佑科技发展有限公司;差式扫描量热仪,DSC821,瑞士梅特勒-托利多集团。
1.1.3 菌株。
瑞士乳杆菌菌株(Lactobacillus helveticus 9),来自中国工业菌种保藏中心(CICC)。
1.2 试验方法
1.2.1 β-半乳糖苷酶脂质体的制备。
卵磷脂和十八胺按10 ∶1的摩尔比例混合,共计45 μmol,溶于20 mL氯仿中,混合均匀。将混合液体置于50 mL的圆底烧瓶中,并以6 r/min的转速在37 ℃以下对其进行旋转蒸发,直至脂质在瓶壁形成薄膜。然后,在圆底烧瓶中分别加入30 mL氯仿和乙醚,溶解脂质薄膜。在超声的条件下,加入含有β-半乳糖苷酶(1 290 μg/mL)的磷酸钠缓冲液(20 mmol/L,pH 7.0)20 mL。持续超声60 min后,再次对其进行旋转蒸发,除去剩余的氯仿和乙醚,直到形成O/W型乳剂,即可得到脂质体。O/W型乳剂通过超声波细胞粉碎机进行均质处理之后,便会形成粒径均匀的单层脂质体。
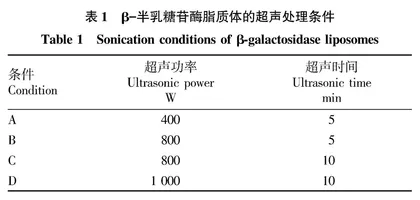
1.2.2 最佳超声条件。
制备少量的单层脂质体,需确定其合适的超声条件。 根据均质机工作时的超声时间和超声功率确定4种制备β-半乳糖苷酶脂质体的超声处理条件(表1)。
1.2.3 β-半乳糖苷酶脂质体的观察。
用TEM1010透射电子显微镜观察复染的β-半乳糖苷酶脂质体形貌。样品制备方法:将稀释3倍的β-半乳糖苷酶脂质体混悬液滴于有Formva膜的400目铜网上,用滤纸吸去多余的液体,滴加2%的磷钨酸水溶液进行复染色。然后取出铜网,将其正面朝上置于玻璃皿中,室温下晾干着色。2 min后,用滤纸吸去多余的液体,在透射电子显微镜下仔细观察并照相。
1.2.4 颗粒大小、粒径分布和Zeta电位的测定。
使用ZS90激光粒度仪对β-半乳糖苷酶脂质体的颗粒大小、粒径分布和Zeta电位进行表征。首先,用蒸馏水稀释β-半乳糖苷酶脂质体混悬液。然后取2~5 mL样品,注入固定的比色皿中,放入ZS90激光粒度仪中,在25 ℃条件下进行检测。经过4种不同超声条件处理过的β-半乳糖苷酶脂质体,需要分别进行检测。
1.2.5 菌株的培养。
使用LH-9验证β-半乳糖苷酶脂质体模型筛选出的冷冻干燥保护剂对菌株冻干保藏的保护效果。将冷冻干燥的LH-9接种在12%的灭菌脱脂乳中,37 ℃下厌氧培养至凝乳。取1%的凝乳放入MRS液体培养基中,37 ℃下厌氧培养24 h。然后将其在6 000 r/min、4 ℃条件下离心15 min获取细胞,备用。
1.2.6 LH-9与β-半乳糖苷酶脂质体的冷冻干燥。
选取海藻糖、透明质酸以及海藻糖和透明质酸(HA)的复配体系作为菌株的冷冻干燥保护剂,分别与LH-9和β-半乳糖苷酶脂质体混合。冻干保护剂以及它们的浓度如表2所示。所有的样品都要先在-45 ℃条件下冻存不少于120 min,然后将冷冻的样品放置于冷冻干燥机中真空冻干20 h。冻干后的样品(粉末)装入密封的低温瓶中,于-20 ℃保存备用。
溶解冻干β-半乳糖苷酶脂质体,取脂质体悬浮液1 mL过Sephadex-G200凝胶柱,脂质体纯化,收集未包封的β-半乳糖苷酶,采用考马斯亮蓝法,测量其中蛋白质浓度[24]。取1 mL样品于比色管中,准确加入5 mL的G-250染色液,混合均匀,静置5 min后于595 nm处测定其吸光度。根据以下公式计算脂质体中β-半乳糖苷酶的包封率:
包封率= 加入酶液中蛋白质浓度-游离蛋白质浓度 加入酶液中蛋白质浓度 ×100%
对冻干的菌粉进行复溶,15 min后,在6 000 r/min、4 ℃条件下离心15 min,收集菌体。收集的菌体用0.89%的NaCl缓冲液清洗后,再次离心。离心所得菌体沉淀中加入30 mL的缓冲液,然后对菌体细胞进行超声破碎处理。破碎条件:超声1 min,间歇0.5 min,共破碎30 min。最后,采用吸光光度法测定悬浮液中β-半乳糖苷酶的酶活力[25]。