全球首例!中国团队成功实现基因编辑猪肝脏人体移植

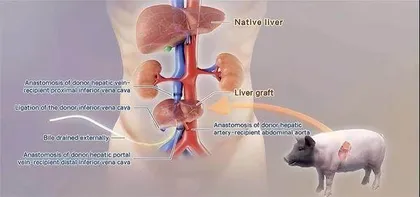
据了解,窦科峰带领西京医院等机构的研究团队,以一只经过6 处基因编辑的猪为供体,将猪的肝脏移植到一名已脑死亡但身体基本机能仍被维持的人的体内,人类受体自身的肝脏被保留,以此模拟临床肝衰竭患者的替代支持治疗过程。观察期为 10 天,直至观察终点,移植的猪肝脏颜色、质地正常,血流动力学良好,能持续分泌胆汁,外周血中的转氨酶、胆红素和猪源性白蛋白等指标变化符合生理预期,凝血功能能够维持在相对稳定状态,受体免疫应答有关的补体活化、T 细胞和 B 细胞反应均被良好抑制。同时,尚未发现猪内源性逆转录病毒在人体传播的情况。
上述研究成果表明:采用六基因编辑策略的供体猪与特定的受体免疫抑制方案相结合,在控制异种肝移植的超急性排斥反应和急性排斥反应方面显示出安全性和有效性。猪肝脏在人体内能够正常地执行其生理功能,并且在短期内不会发生跨物种感染。
这是全球范围内第一次将基因编辑猪肝脏移植入人体,该项研究的成功是异种器官移植领域的重大突破,是异种肝移植迈向临床应用的关键一步,将有助于解决移植器官短缺问题。
延伸阅读
异种器官移植:科学突破与伦理挑战并存的未来之路
不同物种间的器官移植被称为异种器官移植。目前全球范围内捐献的人体器官供应不足,异种器官移植被视为缓解器官短缺问题的一个潜在解决方案。医学界此前曾尝试使用黑猩猩和狒狒等灵长类动物的肾脏和肝脏作为移植来源,但效果都不理想。
猪的组织结构和生理功能与人类器官相似,且由于与人类的亲缘关系较远,传播人畜共患病的可能性较低。此外,猪的养殖成本不高,种类繁多,且繁殖力强,这些因素使得科学家们将猪视为异种器官移植的理想供体候选者。然而,将猪器官移植到人体中仍面临两大挑战:一是猪的基因中含有内源性逆转录病毒,这可能在移植后对人体产生毒性;二是猪器官可能会激起人体免疫系统的排斥反应。
基因编辑技术和免疫学的发展为人体移植猪器官扫除了障碍。科学家可以通过基因编辑技术去除或关闭猪身上有风险的基因,并插入一些人类基因,从而提高接受移植者长期存活的可能性。中美等国研究人员 2017 年报告说,他们用基因编辑技术“敲除”了猪基因组中所有内源性逆转录病毒。巴西圣保罗大学生物科学研究所研究人员 2019 年报告说,科学家已确认猪体内能引发人体排斥反应的 3 个基因,使用基因编辑技术关闭这些基因就可能消除排斥反应。
在这些进展的基础上,医学界逐步探索开展猪器官移植手术,其中美国进展迅速。2022年 1 月,美国马里兰大学专家进行了全球首例将基因编辑猪的心脏移植到人体的手术,患者术后存活了约 2 个月。2023 年 9 月,该机构完成第二例基因编辑猪心脏移植手术,患者约 40天后死亡。
肾脏移植也是探索的热点领域。2023 年 7月,美国纽约大学兰贡医疗中心将基因编辑猪的肾脏移植到一名已脑死亡但维持生理机能的受试者体内,猪肾脏能正常工作。2024 年3 月,美国马萨诸塞综合医院将基因编辑猪的肾脏移植入一名美国男性终末期肾病患者体内,为全球首例。这名时年 62 岁的患者在手术后近 2 个月死亡,但医院发表声明说,没有迹象表明他的死亡是由肾脏移植造成。
正如上述案例所述,患者术后存活率低是制约异种器官移植的一大挑战。不过,每一次失败都是迈向成功的基础。
2024 年 12 月,美国纽约大学兰贡医疗中心宣布,成功为一名 53 岁女性肾病患者进行了基因编辑猪肾脏移植手术。2025 年 2 月 25 日,兰贡医疗中心发布公报说,这名女性接受移植手术满 3 个月后已返回家中,后续还要定期复查,她已成为移植基因编辑猪肾脏后存活最久的患者。
上述移植手术都是在美国食品和药物管理局“同情使用”规则下进行的。该规则适用于有严重或危及生命疾病的患者,在不能通过已上市药品或入组临床试验的方式获得有效治疗时,可使用未经上市审批的研究性药物或治疗手段。
2025 年 2 月初,美药管局正式批准两家生物公司开展猪肾脏移植临床试验,标志着这一领域从“实验性尝试”走向“临床验证”的新阶段。美国媒体报道说,“一旦成功,这些试验可能会彻底改变器官移植现状,帮助解决供体肾脏严重短缺的问题”。
尽管异种器官移植在缓解移植器官短缺问题上被寄予厚望,但目前它仍然面临着诸多挑战。这些挑战包括排斥反应可能难以彻底避免,以及跨物种移植可能带来的生物安全隐患。除此之外,医学界对于人体移植动物器官后的长期健康影响、接受移植者的生活质量以及移植器官功能的维持状况等方面的研究尚不充分。同时,异种器官移植还牵涉到人类学、社会学、伦理学等多个学科领域的问题,可能会对社会伦理产生影响。
鉴于此,医学界呼吁,推进异种器官移植,需要国际社会、各国政府、科研及医学界等多方合力、审慎推进,要科学评价研究进展,清醒认知相关风险,并加强立法监管。
(综合整理自新华社、空军军医大学微信公众号)