弼猴桃性别决定机制与鉴定方法研究进展
作者: 张卉 谢玥 李明章 庄启国 何盈春 杜奎引用格式:,等.猕猴桃性别决定机制与鉴定方法研究进展[J].湖南农业科学,2025(6):96-101.DOI:10.16498/j.cnki.hnnykx.2025.006.017
中图分类号:S663.4 文献标识码:A 文章编号:1006-060X(2025)06-0096-06
Research Progress inMechanisms of Sex Determination and Methodsof Sex IdentificationinKiwifruit
ZHANG Hui,XIE Yue,LI Ming-zhang,ZHUANG Qi-guo,HE Ying-chun,DU Kui (SichuanProvincialAcademyofNatural ResourceSciences,China-New ZealandBeltandRoadJointLaboratoryonKiuifruit,Key Laboratory ofBreedingand Utilizationof Kiwifruit in SichuanProvince,Chengdu 6loo41,PRC)
Abstract:Asaepresentativespeiesof tegesActidiaitnthefmilyActiidiaceae,kiwfruit (Atidias.)isoed asthe"KingofVitaC"duetitsutriechfruitsarticlarlyitseceptioalliginConteHowev,tediiou natureofkiwifruit posessignificantchallengesforitsgeneticbreedingandcultivationmanagement.Thisreviewsummarizesecent researchadvancesinteevolutioanddeterminationmechanismsofsexinkiwifruit,aswellasthecurrentapplicationstatusofsex identificationtods,dngopological,iologicalndoceical,adlecuararkerproacs.Itsoid perspectivesonfutureresearchdirections,mingtoprovideareferenceforadvancementsinthefeldofkiwifruitsexidentification.
Keywords:kiwifruit;sex;determination mechanism; identification;review
猕猴桃是弼猴桃科(Actinidiaceae)猕猴桃属(ActinidiaLindl.)植物的总称,为浆果类多年生雌雄异株落叶藤本植物。弼猴桃果实营养及药用价值高,含有多种对人体健康有益的成分,尤其富含维生素C,有“VC之王”的美誉,是20世纪人工驯化栽培最成功的国际新兴水果之一[]。实生选种是目前猕猴桃的主要育种途径,除两性花品种‘龙山红’外[2],大多数弼猴桃为功能性雌雄异株植物,从花的形态结构上看,雌株的花蕾是具有两性器官的完全花,但雌株花蕾内花粉败育,必须经过授粉才能坐果;雄株的花无胚珠形成,雌蕊不育,但可以提供具有活力的花粉[3];弼猴桃种子数量多,一般有400\~600粒/果,有的甚至高达1300粒/果[4,且后代中常出现雄株多于雌株现象,如果实生播种,弼猴桃童期超过 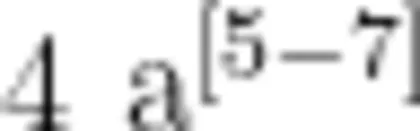 。因此,在猕猴桃早期进行性别鉴定对于节约育种成本、提高育种及生产效率是十分必要的。
。因此,在猕猴桃早期进行性别鉴定对于节约育种成本、提高育种及生产效率是十分必要的。
大量研究表明,植物性别由遗传因子、表观遗传修饰、植物激素等因素相互作用来决定,呈现多态性[8-9]。目前已发现猕猴桃在性别表达上至少包括6种不同的表现型,并且6种表型内还存在着不同变异[0]。除表型具有多样性外,猕猴桃种类繁多、染色体倍性复杂[1],这些因素给弼猴桃性别鉴定工作造成困难,增加了弼猴桃性别鉴定的难度。早在20世纪80年代学者们就开始进行弼猴桃雌雄株早期性别鉴定方法的研究,随着分子生物学的不断发展,一些性别分化基因研究得以不断深入,性别分化机制逐渐得以揭示,弼猴桃性别鉴别方法也从最初的形态学鉴定发展到更准确便捷的分子鉴定方向。
本文主要对近年来国内外弼猴桃性别决定机制和性别鉴定技术研究文献进行综述,了解研究进展以及性别鉴定方面存在的问题,对其未来发展提出展望,为弼猴桃性别鉴定领域研究提供参考。
1弼猴桃性别进化与决定机制
弼猴桃雌株的雄花与雄株的雌花都属于形态上的两性花,生理上的单性花。在开花植物中,两性花植株被认为是原始性别类型,也是最常见的,而雌雄同株和雌雄异株的单性花被认为经过多次进化才出现,可能起源于两性花植物[12-13]。Charlesworth等[14]提出了雌雄异株型植物进化的一个代表性的理论模型—“双突变模型”,此模型有助于阐明单性花植物是如何通过一系列独立的雌性化和雄性化突变直接从两性花植物进化而来的,理论预测至少需要2个基因突变才能将两性花物种转变为性别分离的单性花物种,一种突变必然影响胚珠的产生,另一种则影响花粉的产生;多倍体化或基因复制事件可能促进这些突变的出现和雌雄同株向雌雄异株的过渡[15]。此外,由于雌雄异株(dioecy)在被子植物史上独立进化了多次[,因此每一次向雌雄异株的过渡都可能涉及不同的基因和进化情况[15]
对于含有性染色体的植物,性别决定基因位于性染色体上,此类被子植物的性别决定分为XX/XY型(包括ZZ/ZW型)X:A型2种。弼猴桃的性别受到异型雄配子系统的控制,属于XY型性别决定系统[17]。Gil等[18]的研究结果支持了六倍体雄性弼猴桃的染色体组成是XXXXXY(或可能是XXXXYY)的设想,尽管弼猴桃雄株中存在多条X染色体,但Y染色体上有一个决定雄性的基因座。通过对中华弼猴桃进行核型观察和多基因连锁图谱的构建[19-20],发现猕猴桃X和Y染色体的外观形态和长度是相似的,但Y染色体亚端粒部位有着不能与X染色体自由重组的性别决定位点,研究者据此推断弼猴桃性染色体还处于进化的早期[21]。Zhang等[22]的研究结果将猕猴桃的性别决定区(sex-determinationregion,SDR)缩小到了25号染色体上的 1Mb 亚端粒区。Akagi等[23]通过研究弼猴桃的雌雄异株进化,发现弼猴桃性连锁片段在25号染色体内形成一个小的 0.49Mb 雄性特异性区域(malespecificregionoftheYchromosome,MsY),两侧为重组区域,这个决定性别的区域内有多个基因,从这些候选基因的遗传多样性模式来看,研究者认为弼猴桃雌雄异株在2000万a前就已经出现了,可能是在古倍化事件之后[15.23]。
在性别决定系统中,认为决定雄性的染色体(Y)被假定携带至少2个显性连锁基因:子房抑制基因(SuF)和花药成熟促进基因( M )[24]。X染色体携带隐性等位基因( suF 和 m ),在2个主要基因座上可能被更好地描述为零基因[25],这2个基因之间的罕见交叉是导致新变异体出现的原因,例如不育个体( SuFm/suFm )和两性体 (suFM/suFm ),弼猴桃属(Actinidia)中已有这2种类型变异的报道[10],从而支持了这2个主要基因参与弼猴桃性别决定的假设,并表明重组事件可能发生在性别决定区域[24]。
植物性别决定基因位于性染色体上的性别决定区域,是雌雄性别分化的分子基础。自2014年第一个植物性别决定基因OGI被克隆至今,已有23种雌雄异株植物的性别决定基因被鉴定,形成了2种模型,即“双基因模型”和“单基因模型”[26],其中“双基因模型”是解释雌雄异株植物性别决定的经典理论,弼猴桃的性别决定属于该模型[27]。
有关弼猴桃性别决定基因的研究,近年来取得了突破性进展,Akagi等[23]首先发现了Y编码的细胞分裂素反应调节因子 SyGl 是2个性别决定因子之一,为雌性发育抑制因子( SuF ),该基因通过对细胞分裂素信号的负调控,在花发育的早期阶段抑制雌蕊心皮的发育,Varkonyi-Gasic等[28]利用CRISPR/Cas9技术同时靶向CEN4和 SyGl 基因促进了中华弼猴桃‘Bruce’雄株的雌蕊发育,进一步证明了SyGI是弼猴桃性别决定中雌性发育的主要抑制因子;Akagi等[27]在后续研究中确定了第二个Y编码的性别决定因子,将其命名为FriendlyBoy(FrBy),它在绒毡层细胞中强烈表达,拟南芥(Arabidopsisthaliana)和烟草(Nicotianatabacum)的基因编辑和互补分析表明 FrBy 独立于SyGI起到维持雄性(maintenanceofmale,M)功能的作用,并且这些功能在被子植物物种中是保守的。Akagi等进一步描述了Y染色体上雄性特异性区域(MSY)的基因结构( Φ<1Mb ),该区域仅包含SyGl和FrBy基因是雄性特异且显著表达的。对一个天然两性花弼猴桃基因组重测序表明,该个体在遗传上是雄性,但Y染色体发生部分缺失,其中包括 SyGl 基因,此外,FrBy在雌性弼猴桃中的表达致使产生了两性花植株。这些结果清楚地表明,Y染色体编码基因SyGl和FrBy分别作为 SuF 和 M 因子独立发挥作用调控弼猴桃性别分化。
弼猴桃 SyGl 和FrBy基因的进化史与芦笋(Asparagusofficinalis)中的双基因座类型的性别决定因素相一致,尽管这些性别决定因素的具体功能不同;芦笋中潜在的 SuF 基因SOFF是通过Y染色体上的谱系特异性基因复制建立的,而潜在的 M 基因MYB35(TDF1)则从X染色体上丢失[27]。柿子(DiospyroskakiThunb.)在Y染色体上进化出一个单一的性别决定因子OGI,它编码抑制常染色体雌性化基因MeGI的sRNAs[29];尽管猕猴桃中的SyGl和柿子中的OGI具体功能不同,但它们都是显性抑制因子,都来自于谱系特异性复制,表明被子植物中不同性别决定系统的进化是一致的[27]。
2弼猴桃性别鉴定方法研究进展
由于雌雄异株植物的性别性状长期在外界环境下的分株表达以及对环境的适应性进化,雌雄异株植物在形态特征、生长特性、抗逆性、生理生化特征以及资源分配等方面都存在着一定的差异[30]。自20世纪80年代起,国内外研究学者相继开展了一系列弼猴桃性别鉴定的相关研究,主要集中于形态学、生理生化、同工酶、分子生物学鉴定方法。
2.1 形态学鉴定
形态学方法主要根据雌雄株不同生长时期的形态特征、物候期和细胞学差异等进行的性别鉴定,在中华弼猴桃、软枣弼猴桃、狗枣弼猴桃性别鉴定中应用广泛。刘文等[31对中华弼猴桃雌雄株的叶片进行了形态学观察,结果发现叶片的保卫细胞长宽比在不同性别的弼猴桃之间差异显著,雄株叶片保卫细胞长宽比大于3,雌株长宽比小于3,并且此标记在不同品种的弼猴桃雌雄株之间也表现稳定。郑涵予等[32]研究发现软枣弼猴桃雌雄株物候期出现的时间差异不大,但两者的叶柄长度存在显著差异,花期后其叶形指数亦差异显著。王学东等[33]研究结果发现狗枣弼猴桃的雌雄花在形态分化初期极为相似,两者难以区分,雌雄花之间的形态差异在雌雄蕊原基开始分化后出现。
形态学鉴定看似简单、易学,但缺乏明确标准判断和预测弼猴桃幼苗的性别,并且容易受到外界生长环境、生长地区、植物发育阶段等因素的影响,难以得到广泛运用,但可以作为一种弼猴桃性别鉴定的辅助方法。此外,弼猴桃雌雄株在其童期形态上区别不明显,大部分形态学鉴定方法都很难在早期对弼猴桃幼苗进行性别鉴定。
2.2 生理生化指标鉴定
前人研究表明雌雄异株植株在一些特异蛋白质、内源激素、次生代谢物等生理生化方面存在差异,通过分析雌雄植株个体之间的这些差异对其性别进行鉴定。
已有研究发现在弼猴桃性别分化特异蛋白质方面,不同性别的弼猴桃植株中特异性蛋白存在着差异。Khukhunaishvili等l用SDS-PAGE法研究了弼猴桃叶片的蛋白质组成,在中华弼猴桃和狗枣弼猴桃的雄性和雌性植株中检测到了与性别相关的特异性多肽。石进校等[34对美味弼猴桃‘米良1号’及配套雄株“帮增1号’在不同发育时期各器官的过氧化物酶(POD)活性检测结果表明,过氧化物酶活性与美味弼猴桃植株性别有关,POD在雌雄株之间的差异可作为判断美味弼猴桃植株性别的依据。
激素与植物的性别分化密切相关,Biasi等[35]通过结合生化和细胞组织学方法研究弼猴桃雌花的雄性不育性,结果发现高水平的多胺与花粉败育有关,此外,在比较雄性可育花和雄性不育花的花药成熟花粉和败育花粉时,碳水化合物水平差异也很大。
有研究表明,植物雌雄个体之间的生理生化代谢差异集中表现在氧化还原能力方面。李旭等[以软枣弼猴桃的雌雄株新梢和休眠枝为试验材料,通过采用形态观察法和生理生化法对植株展开性别鉴定研究,结果表明氯化三苯基四氮唑法(TTC染色法)可作为成龄软枣弼猴桃雌雄株性别鉴定的有效方法,但其对弼猴桃的早期性别鉴定是否适用还有待于进一步研究探讨。
总之,这些性别特异蛋白质、激素等生理生化方面的研究成果为弼猴桃雌雄株性别的早期鉴定提供了重要的参考依据。植物雌雄植株在生理生化方面的差异是植物性别鉴定的理论基础,但这种方法并没有从根本上去解释雌雄异株植物的不同,且这种方法使用的大多数材料集中在成年植株,童期植株涉及很少,因此生理生化指标鉴定方法可靠性还比较欠缺,但其研究成果为弼猴桃性别鉴定提供了重要的参考价值。
2.3 DNA分子标记
随着分子生物学的快速发展,对植物性别鉴定的方法已深人到基因层面。近年来利用DNA分子标记开展植物性别鉴定的研究发展迅速。DNA分子标记是以个体间遗传物质核苷酸序列变异为基础,是DNA水平遗传变异的直接反映[37]。利用DNA分子标记方法比较植物不同性别的核苷酸序列差异开展性别鉴定,在许多方面都优于形态学、生理生化、同工酶等鉴定方法。例如,DNA分子标记可不受环境、植物生长周期和组织特异性等影响;许多DNA分子标记为共显性标记,能区分纯合和杂合的基因型,鉴定结果准确度更高;DNA分子标记可结合BSA(Bulkedsegregantanalysis)等分析方法在整个基因组中筛选所需要的信息,完成覆盖整个基因组的分析,信息覆盖面广。因此,基于以上DNA分子标记所具有的可靠性、准确性等优点,越来越多的研究将其应用到植物性别鉴定。
在弼猴桃性别鉴定方面,常用早期的DNA分子鉴定标记包括RAPD、SCAR、SSR、SRAP、SNP、AFLP等,近年来科学家们已经利用分子标记技术相继开发出了弼猴桃性别特异性标记或利用多态性分子标记引物对弼猴桃不同性别植株进行了分子鉴定(表1)。
研究者后续对已开发的性别分子标记展开了一系列通用性验证,例如,Harvey等以中华弼猴桃杂交群体为试验材料开发的RAPD性别特异性标记——SmY(雄性标记) smX (雌性标记),后来经Gill等将其转化为更为稳定的SCAR标记,Murakami等[46]将转化后的SCAR标记的通用性在中华弼猴桃品种‘RainbowRed’中进行验证,结果表明 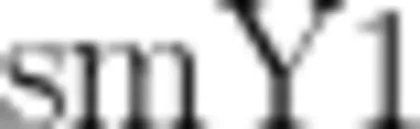 的准确率可达到 95% 。郭丹丹等[47-48]以64份中华弼猴桃复合体材料对SCAR标记 smX 和
的准确率可达到 95% 。郭丹丹等[47-48]以64份中华弼猴桃复合体材料对SCAR标记 smX 和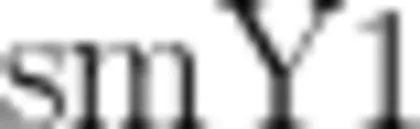 进行验证,结果发现 smX 标记没有表现出性别特异性,而
进行验证,结果发现 smX 标记没有表现出性别特异性,而 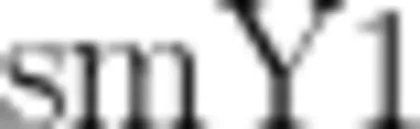 标记性别鉴定准确率很高,雄株鉴定准确率为 96.55% 、雌株准确率可达到 100% ,但 smX 和 SmY1 均不能有效鉴定64份软枣弼猴桃样品性别。张坤等[收集并验证了前人已开发的3组弼猴桃性别分子标记,结果表明 smX 标记也没有表现出性别特异性,而
标记性别鉴定准确率很高,雄株鉴定准确率为 96.55% 、雌株准确率可达到 100% ,但 smX 和 SmY1 均不能有效鉴定64份软枣弼猴桃样品性别。张坤等[收集并验证了前人已开发的3组弼猴桃性别分子标记,结果表明 smX 标记也没有表现出性别特异性,而 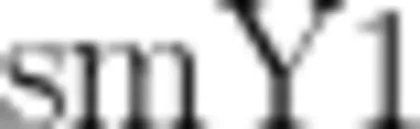 标记可以准确鉴定弼猴桃的性别,雄性植株鉴定准确率为 85% ,雌性植株准确率也可达到 100% 。综合已有研究结果, smX 标记对鉴定弼猴桃性别效果不很理想,
标记可以准确鉴定弼猴桃的性别,雄性植株鉴定准确率为 85% ,雌性植株准确率也可达到 100% 。综合已有研究结果, smX 标记对鉴定弼猴桃性别效果不很理想, 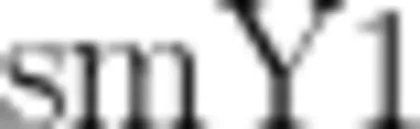 标记能有效鉴定中华弼猴桃雌雄株性别,结果较为稳定可靠,但
标记能有效鉴定中华弼猴桃雌雄株性别,结果较为稳定可靠,但 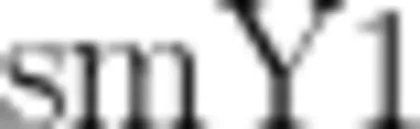 标记在鉴定其他种弼猴桃性别的通用性如何还需开展更多研究。
标记在鉴定其他种弼猴桃性别的通用性如何还需开展更多研究。
表1弼猴桃性别分子鉴定研究
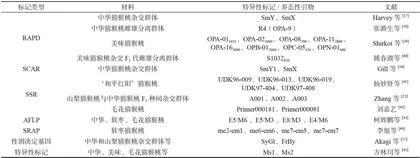
姚春潮等[40]以美味猕猴桃杂交 F1 代为实验材料,利用RAPD技术将从中得到的雄性连锁的RAPD标记-S1032850,将其在海瓦德与秦雄201杂交组合的 F1 代、亲本及美味弼猴桃、中华弼猴桃雌雄株个体上进行验证,结果表明该雄性特异性标记带存在于实验用所有雄株样本中(共22株),但在大多数的雌株样本中没有出现此带;张坤等[研究结果则表明该标记未表现出性别特异性,不能广泛应用于弼猴桃雌雄株鉴定。因此,雄性连锁的RAPD标记-S1032850其鉴定弼猴桃性别的准确性还需更多的验证。
Zhang等[22]以山梨弼猴桃和中华猕猴桃 F1 种间杂交群体为材料开发了3个性别特异性简单重复序列(SSR)标记-A001、A002和A003,其可靠性在该研究中所用174个 F1 代个体中得到验证。然而郭丹丹研究中所用的64份中华弼猴桃复合体样品中A001、A002和A003标记的性别鉴定准确率都较低,也不具有性别特异性,且这3个SSR标记在64份软枣弼猴桃样品中也没有表现出性别特异性[47];吕正鑫等[1]研究表明A001、A002和A003等8个性别标记在毛花弼猴桃性别鉴定上不具有通用性,不能将其用于毛花猕猴桃的性别鉴定;刘嘉艺[42]研究也发现A001、A002和A003未在毛花、软枣弼猴桃等样品中扩增出性别特异性条带。在弼猴桃性别鉴定方面,这3个SSR标记不能作为种间通用的分子标记。
此外,郭丹丹[47]以软枣弼猴桃杂交组合后代群体为材料,通过全基因组重测序以及BSA分析技术开发了性别鉴定分子标记,通过筛选得到了2对雄性特异性引物Primer11和Primer51,其可靠性在该研究的128个软枣弼猴桃样品中得到验证;该研究进一步将这两个雄性标记在48份中华弼猴桃复合体材料中进行通用性验证,结果表明Primer11在鉴定中华弼猴桃复合体的性别方面具有一定的准确率,但还需要扩大群体作进一步验证,Primer51则不适用于鉴定中华弼猴桃性别。
最近,方林川等[45]研究基于弼猴桃Y染色体性别决定非重组区中抑雌基因 SyGl 与促雄基因 FrBy 的外显子保守序列设计引物,利用不同群体材料对其进行有效性验证,结果筛选获得2个性别特异性标记(Ms1、Ms2),可用于猕猴桃性别鉴定。开发出的多重(ITS、Ms1及Ms2)PCR体系及荧光毛细管电泳检测体系,总体鉴定准确性达到 95.11% 。
3展望
目前,弼猴桃“双基因”性别决定机制已被揭示,研究者在弼猴桃中已相继开展了雄性特异性区域(MSY)、性别决定基因SyGl、FrBy的功能及调控机制等研究。弼猴桃性别鉴定方法也从最初的形态学、生理生化、同工酶等方法发展到现今较为成熟准确的分子生物学鉴定方法。随着基因芯片、高通量测序等现代分子生物学技术的发展,在分子水平上对猕猴桃性别的分化与决定机制的揭示已走向深人,弼猴桃性别决定区域也逐步被定位和缩小,参与弼猴桃性别决定的基因也被发现,性别分化过程中一些转录因子、miRNA的功能及作用机制也越来越受到关注。然而,如何控制性别转换的“总开关”仍是一个未解课题。未来为深人解析猕猴桃性别决定机制,一是要扩大研究材料范围,选择雌雄同株与雌雄异株材料进行比较基因组学、转录组学等研究,同时还可以与近缘雌雄异株物种进行比较研究,尽管性别决定机制存在多样性,但对不同物种中已知的性别决定基因和候选基因的初步比较分析表明,相似的基因和途径可能在植物雌雄异株的进化中被反复使用[49;二是新兴的长读长测序技术PacbioHiFi、超长OxfordNanopore Technologies(ONT)等三代测序技术,以及生物信息学分析方法、基因编辑技术将在研究性别分化、性别决定基因和雌雄异株进化遗传机制中发挥重要作用,利用这些方法将阐明性别决定的分子机制,性别决定机制的研究重点也可能会延展至性别决定基因的上下游和性别决定的整个调控网络通路方向;三是植物性别决定是极其复杂的生物调控过程,表观遗传修饰在其中发挥不可替代的作用[50],小干扰RNA、微小RNA、和DNA甲基化等在植物性别决定中的调控研究将不断深入,表观遗传调控在植物性别决定通路中的作用机制将慢慢被揭示,为人为干预性别分化提供科学依据。
随着分子生物学的发展,越来越多的研究学者试图寻找不同性别的弼猴桃在DNA分子水平上的差异,采用DNA分子标记的方法对弼猴桃开展性别鉴定。但由于弼猴桃种类繁多、倍性复杂,分子鉴定也存在着开发特异分子标记较为困难、验证群体较小、种间通用性较差、费用较高等问题,因此在弼猴桃性别分子鉴定方面还需要开发新的稳定的通用性好的分子标记、扩大验证群体等方法。对弼猴桃性别的鉴定还存在着鉴定方法较为单一的问题,例如单从形态学或者分子角度开展鉴定,如果能将细胞生物学、生物化学、分子生物学等方法相结合,鉴定结果应该会更加准确可靠。
此外,自前大部分弼猴桃性别鉴定方法是基于已知性别材料,而非真实的幼苗性别鉴定,其方法的实际运用效果尚待验证。未来,开发轻简、准确、价廉的弼猴桃早期性别鉴定仪器设备将有助于加速弼猴桃育种。
参考文献:
[1]周玲艳,秦华明,梁红.分子标记在猕猴桃性别基因研究中的应用[J].河南农业科学,2007,36(8):10-12.
[2]王明忠,蒲仕华.彩色猕猴桃两性花新品种龙山红的选育[J].中国果树,2012(6):1-3.
[3]康宗利,王宁,杨玉红,等.猕猴桃性别鉴定研究进展[J].北方园艺,2011(20):184-187.
[4]钟彩虹.猕猴桃栽培理论与生产技术[M].北京:科学出版社,2020.
[5]KHUKHUNAISHVILIRG,DZHOKHADZEDI.Electrophoreticstudy of the proteins from Actinidia leaves and sex identification[J].PrikladnaiaBiokhimiiaiMikrobiologiia,2006,42(1):117-120.
[6]张坤,江欣瑶,王琰,等.猕猴桃雌雄株分子标记的收集、评价与应用[J].四川农业大学学报,2021,39(4):541-548.
[7]罗有良,易春.红肉猕猴桃实生后代若干性状遗传规律研究[J].湖南农业科学,2009(6):134-136.
[8] LABOUCHE A M,PANNELL JR.A test of the size-constrainthypothesis fora limit to sexual dimorphismin plants[J].Oecologia,2016,181(3):873-884.
[9]杜彬彬,李交昆,唐璐璐.被子植物雌雄异株性别决定与性别连锁标记[J].生命科学研究,2017,21(2):159-165.
[10]MCNEILAGE MA.Progressin breedinghermaphroditekiwifruitcultivars and understanding the genetics of sex determination[J].ActaHorticulturae,1997(444):73-78.
[11]吕正鑫,刘青,廖光联,等.性别分子标记在毛花猕猴桃中的通用性验证[J].江西农业大学学报,2021,43(2):261-269.
[12] TANURDZIC M,BANKS JA. Sex-determining mechanisms inland plants[J]. The Plant Cell,2004,16(Suppl):S61-S71.
[13]周赛,陈宸,刘晓虹,等.黄瓜性别决定研究进展[J].植物生理学报,2019,55(7):902-914.
[14]CHARLESWORTHB,CHARLESWORTHD.Amodelfortheevolution of dioecy and gynodioecy[J].The American Naturalist,1978,112(988):975-997.
[15] CASEYs C.Shy girl gives kiwifruit male flowers[J]. The Plant Cell,2018,30(4): 739-740.
[16]RENNER S S. The relative and absolute frequencies of angiospermsexual systems ∵ dioecy,monoecy,gynodioecy,and an updatedonline database[J].American Journal ofBotany,2014,101(10):1588-1596.
[17]HARVEYCF,GILLGP,FRASERLG,et al. Sex determinationinActinidia.1. Sex-linked markers and progeny sex ratio in diploid A.chinensis[J]. Sexual Plant Reproduction,1997,10(3):149-154.
[18] GILLGP,HARVEYCF,GARDNERRC,et al.Developmentof sex-linked PCR markers for gender identification in Actinidia[J].Theoretical and Applied Genetics,1998,97(3): 439-445.
[19] HE ZC,HUANG HW,ZHONG Y.Cytogenetic study of diploidActinidiachinensis-karyotype,morphology of sex chromosomesatprimary differentiation stage and evolutionary significance[J].ActaHorticulturae,2003(610):379-385.
[20] FRASERLG,TSANGGK,DATSONPM,etal.A gene-richlinkage map in the dioecious species Actinidia chinensis(kiwifruit)reveals putative X/Y sex-determining chromosomes[J].BMCGenomics,2009,10:102.
[21]MINGR,BENDAHMANE A,RENNER S S.Sex chromosomesin land plants[J].Annual Review of Plant Biology,2011,62:485-514.
[22] ZHANGQ,LIUCY,LIUYF,et al.High-density interspecificgenetic maps of kiwifruit and the identification of sex-specificmarkers[J].DNAResearch,2015,22(5):367-375.
[23]AKAGIT,HENRYIM,OHTANIH,etal.AY-encodedsuppressor of feminization arose via lineage-specific duplication of acytokinin response regulator in kiwifruit[J]. The Plant Cell,2018,30(4): 780-795.
[24] TESTOLINR,MESSINAR,LAINO,et al.A natural sex mutantinkiwifruit(Actinidiadeliciosa)[J].New Zealand journal ofcropand horticultural science,2004,32(2):179-183.
[25] LARDON A,AGHMIR A,GEORGIEV S,et al. The Ychromosome of white campion ∵ sexual dimorphism and beyond[M].Oxford,UnitedKingdom ∵ Bios Scientific Publisher,2004.89-99.
[26] 罗兰莎,宋雯佩,化青珠,等.植物性别决定基因及其表观遗传调控研究进展[J].植物学报,2024,59(2):278-290.
[27] AKAGI T,PILKINGTON S M,VARKONYI-GASIC E,et al.Two Y-chromosome-encoded genes determine sex in kiwifruit[J].Nature Plants,2019,5(8):801-809.
[28] VARKONYI-GASIC E,WANG TC,COONEY J,et al. ShyGirl,a kiwifruit suppressor of feminization,restricts gynoeciumdevelopment via regulation of cytokinin metabolism andsignalling[J].NewPhytologist,2021,230(4):1461-1475.
[29] AKAGI T,HENRYIM,TAOR,etal.Plant genetics.AY-chromosome-encoded smallRNAactsasa sexdeterminantinpersimmons[J].Science,2014,346(6209): 646-650.
[30]金君,辛树权,韦欣霈,等.自然越冬期软枣猕猴桃雌雄株的生理生化响应差异[J].长春师范大学学报,2023,42(10):86-91.
[311刘文.杨妙贤,梁红.中华獅猴桃不同性别叶片的形杰学和解剖学观察[J].仲恺农业工程学院学报,2011,24(4):5-11.
[32] 郑涵予,李越,金香花,等.软枣猕猴桃雌雄株生长过程中植株形态及主要次生代谢产物变化[J].延边大学农学学报,2018,40(4):16-21.
[33]王学东,苍晶,吴秀菊.狗枣猕猴桃花芽分化的观察[J].东北农业大学学报,2001,32(3):285-289.
[34]石进校,刘应迪,李菁,等.美味猕猴桃米良1号的过氧化物酶活性[J].吉首大学学报(自然科学版),2001,22(2):36-37.
[35]BIASIR,FALASCAG,SPERANZAA,etal.Biochemicalandultrastructural featuresrelatedtomalesterilityinthedioeciousspeciesActinidia deliciosa[J].Plant Physiology and Biochemistry,2001,39(5):395-406.
[36]李旭,曹万万,姜丹,等.基于形态观察法和生理生化法的软枣猕猴桃性别鉴别研究[J].北方园艺,2014(24):6-9.
[37]刘明,王继华,王同昌.DNA分子标记技术[J].东北林业大学学报,2003,31(6):65-67.
[38]张潞生,肖兴国,李绍华,等.与猕猴桃雌雄性别连锁的RAPD标记筛选[C].中国园艺学会第九届学术年会论文集,中国重庆,2001.76-79
[39]SHIRKOTP,SHARMADR,MOHAPATRAT.Molecularidentification of sexinActinidia deliciosa var. deliciosabyRAPDmarkers[J].Scientia Horticulturae,2002,94(1/2):33-39.
[40]姚春潮,王跃进,刘旭峰,等.猴桃雄性基因RAPD标记S1032-850的获得及其应用[J].农业生物技术学报,2005,13(5):557-561.
[41]杨妙贤,刘文,周玲艳,等.利用多分子标记分析‘和平红阳'猕猴桃的性别差异[J].果树学报,2014,31(1):13-19.
[42] 刘嘉艺.基于毛花猕猴桃基因组SSR的性别鉴定分子标记的筛选和通用性验证[D].合肥:合肥工业大学,2021.
[43]柯辉鹏,李小丹,周玲艳,等.不同猕猴桃品种雌雄植株的AFLP分析[J].仲恺农业技术学院学报,2007,20(3):7-12.
[44] 李旭,吴松权,姜明亮,等.软枣猕猴桃性别相关的 SRAP分子标记[J].江苏农业科学,2016,44(8):69-71.
[45]方林川,张鸿,陈志伟,等.猕猴桃性别特异性毛细管荧光分子标记开发[J].中国南方果树,2024,53(3):7-15.
[46]MURAKAMI S,KATAI H,YAMADAS,et al. Thevalidityofmarker-assisted selection usingsex linked SCAR markers in kiwifruit(Actinidia chinensis cv‘rainbow red’)seedlings[J]. ShokubutsuKankyoKogaku,2015,27(2):68-74.
[47]郭丹丹.软枣猕猴桃(Actinidiaarguta)性别相关分子标记的开发及应用[D].北京:中国农业科学院,2019.
[48] 郭丹丹,钟云鹏,方金豹,等.猕猴桃性别分子标记在软枣猕猴桃中的通用性验证[J].果树学报,2019,36(5):549-556.
[49]MONTALVAOAPL,KERSTENB,FLADUNGM,et al.Thediversity and dynamics of sex determination in dioecious plants[J].Frontiers in Plant Science,2021,11:580488.
[50]杨琳琳,黄云彤,付泽元,等.园艺植物性别决定的表观遗传机制研究进展[J].园艺学报,2022,49(7):1602-1610.
(责任编辑:谢培庚)
本文为全文原貌 未安装PDF浏览器用户请先下载安装
原版页码:hnkx20250617.pd原版全文