基于“科学探究与实践”素养培育的项目式教学设计
作者: 卫环环
【摘要】项目式学习作为改变学生学习方式、促进深度学习、实现育人方式转变的有效方式备受关注。文章通过分析新课程标准对科学探究与实践核心素养的内涵及教学策略,以项目式学习“探索燃烧的奥秘——物质的变化”为案例,提出从领会素养目标内涵突显核心素养培育、合理选择学习内容关注认知思维的逻辑结构、合理设计实验探究活动发展科学探究的视角下开展项目式教学,落实科学探究与实践核心素养的有效教学策略。
【关键词】中学化学;项目式教学;科学探究与实践;培育
【中图分类号】G633.8【文献标志码】A【文章编号】1004—0463(2023)21—0076—05
《义务教育化学课程标准(2022版)》(以下简称新课标)明确指出:科学探究与实践是化学核心素养的重要组成部分,科学探究活动是通过实验探究,让学生经历科学发展的过程,增强学生的实践能力,发展学生学科核心素养的重要途径。然而反思传统实验教学没有被重视,教师黑板讲实验、播放实验视频、播放虚拟仿真实验等教学方式,学生缺乏真实的实验体验,缺乏参与实验探究的机会,学生实验操作技能、科学探究的能力、科学方法、科学态度、科学能力的培育不能得到有效落实。
一、核心素养视域下“科学探究与实践”核心素养培育策略
2014年,在教育部印发的《关于全面深化课程改革落实立德树人根本任务的意见》中,“核心素养”首次被置于深化课程改革、落实立德树人目标的基础地位,“核心素养”指学生应具备的适应终身发展和社会发展需要的必备品格和关键能力,突出强调个人修养、社会关爱、家国情怀,更加注重自主发展、合作参与、创新实践。从价值取向上看,它“反映了学生终身学习所必需的素养与国家、社会公认的价值观”。从指标选取上看,它既注重学科基础,也关注个体适应未来社会生活和个人终身发展所必备的素养;不仅反映社会发展的最新动态,同时注重本国历史文化特点和教育现状。《普通高中化学课程标准(2017版)》提出化学学科的五大核心素养,分别为“宏观辨识与微观探析”“变化观念与平衡思想”“证据推理与模型认知”“科学探究与创新意识”“科学精神与社会责任”,而在新课标下,化学学科核心素养在义务教育阶段和高中阶段有了明显的区分,义务教育阶段的化学学科核心素养改为“化学观念”“科学思维”“科学探究与实践”“科学态度与责任”,其中“科学探究与实践”的核心是培养学生主动提出有探究价值的问题、设计探究方案、独立或与同学合作完成实践探究,获取证据和结论,能从化学视角对常见生活现象、跨学科问题解决与化学有关的问题。因此,“科学探究与实践”核心素养的培养策略就是在教学中充分挖掘学科知识背后隐性的学科思想、学科观念、学科方法,从超越知识表面角度实现知识所承载的素养功能。在设计教学目标时要突出“科学探究与实践”核心素养的发展水平进阶,在教学内容选择时应关注真实的生活、生产、实验探究情境,在选择学习方式时应体现学生学习的自主性、合作性、探究性,让学生经历科学探究的过程,体验科学探究的思路,充分落实“做中学、用中学、创中学”的教学理念,引导并帮助学生进行科学探究,培养创新精神、提高解决问题的能力[1]。
二、基于“科学探究与实践”素养培育的项目式教学设计——“探索燃烧的奥秘——物质的变化”案例设计
(一)设计思想
1.领会核心素养内涵,突显教学目标的素养发展。“探索燃烧的奥秘”在教学目标设计中依据新课标提倡的学科育人价值,即通过引导学生探索燃烧的奥秘,分析生产生活中调控燃烧的技术方法,调查燃料的变迁并分析其中的原因,逐步形成适应个人终身发展和社会发展所需要的正确价值观、必备品格和关键能力,体现目标对发展化学核心素养的重要价值。
2.合理选择学习内容,关注认知思维的逻辑结构。“探索燃烧的奥秘”在组织实验教学内容时,选择依据新课标提倡的构建大概念统领的化学课程内容体系,即围绕“物质的化学变化”学习主题,构建“物质的变化与转化”学科大概念,通过三个项目活动的设计,选取燃烧的条件、调控燃烧的技术方法等具体学习内容,既包括核心知识,又包括对科学思维、科学探究与实践和科学态度与责任等核心素养的要求,充分发挥大概念对实现知识的结构化和素养化的功能价值,全面反映、落实课程内容体系的培养要求和目标。
3.充分发挥化学实验的价值,积极开展科学探究与实践活动。“探索燃烧的奥秘”在开展科学探究与实践活动时注重启发式、互动式、探究式教学,充分发挥化学实验的价值,开展以化学实验为主的多样化探究与实践活动,即以日常生活中最常见的燃烧现象入手,以蜡烛的燃烧为起点,以展望和设计未来的燃料为终点,创设真实问题情境,开展项目式学习。
(二)项目分析
第七单元“燃料及其利用”属于“物质的化学变化”学习主题,新课标要求“学生通过实验探究认识燃烧的条件,理解燃烧和灭火的原理及其在生活中的应用,初步体会调控化学反应的重要意义”。本项目以生活中常见的燃烧现象为切入点,分别介绍了“燃烧是如何发生的”“如何调控燃烧”以及“未来的燃料是怎样的”三个子项目,从学生熟悉的实验现象出发,以燃烧为载体,引导学生从实际生活中体会化学学科思想,以此建立认识化学的正确视角,帮助学生进一步发展“物质的变化与转化”大概念,认识燃烧与灭火的本质是可燃物的化学反应,并学会从能量的视角看待化学反应,体会人类利用和调控燃烧的思路和方法。
(三)教学目标
1.认识物质燃烧所发生的化学变化,认识氧气在燃烧中发挥的作用,发展科学探究的设计思路。
2.认识燃烧、缓慢氧化和爆炸发生的条件,认识外界条件物质转化的影响,初步建立通过内外因辩证视角看待化学问题的视角。
3.了解防火灭火、防范爆炸的措施,认识燃烧的条件和调控方式,体会控制变量在科学探究中的应用。
4.评估燃料对环境的影响,了解如何选择对环境影响较小的燃料,树立学生科学自然观和绿色发展观。
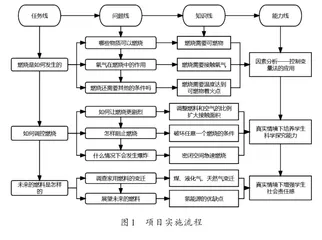
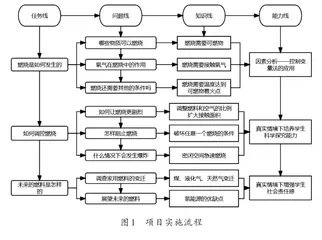
(四)项目实施流程(如图1)
(五)项目活动实施过程
【情境】我们周围有很多熟悉的燃烧现象,例如做饭时用柴草、煤或天然气作为燃料,餐馆里或实验室里点燃酒精用于加热,定向爆破过程中利用了炸药爆炸的作用。这些都是燃料在燃烧,除了这些常见的燃料之外,那么燃烧是如何发生的,还有哪些物质可以燃烧呢?
任务1:燃烧是如何发生的?
活动1:哪些物质可以燃烧?
【实验探究】请同学们以小组为单位,在酒精灯的火焰上加热以下物质:木炭、木条、蜡烛、镁条、淀粉、塑料、大理石、玻璃等。观察它们能否燃烧以及燃烧的现象。
【问题】你知道的生活中的燃烧现象还有哪些?请环顾教室四周,周围的物品都是由什么材料制成的?它们可以燃烧吗?
【结论】从物质的角度,我们会发现有的物质可以燃烧,如酒精、蜡烛、火柴;有的物质不能燃烧,如水、玻璃、大理石。于是,可以把物质按照是否可燃分为两类:可燃物和不可燃物。可燃物是燃烧的条件之一。
【学习方式】请以小组为单位查找资料,指出建筑工地有哪些可燃物,并讨论该如何改进选用的材料来减少火灾的发生。
活动2:氧气在燃烧中的作用。
【情境】用灯帽罩在酒精灯上或者烧杯罩在蜡烛上使火焰熄灭,都是因为隔绝了空气,燃烧无法进行。在学习化学之前,同学们已经知道燃烧是可燃物与空气中的氧气发生的化学变化。空气中含有氧气、氮气等多种成分,那么大家有没有想过,如何才能说明是氧气发挥的作用呢?
【问题】因为空气的主要成分是氧气和氮气,可忽略其他含量很低的组分对燃烧的影响。那么氧气和氮气就是我们要探究的两个影响因素。要说明某一组分是否支持燃烧,可用这种组分的纯物质来进行实验,以消除其他因素的影响。
【实验探究】小组合作完成实验1~5,探究物质在纯氧或氮气中能否燃烧。
实验1:把带火星的木条伸入盛有氧气的集气瓶中,观察实验现象。
实验2:取一小块木炭,在空气中加热至燃烧,观察现象。然后将其伸入盛有氧气的集气瓶中,再观察实验现象。木炭熄灭后取出,向集气瓶中加入少量澄清石灰水,振荡,观察现象。
实验3:在燃烧匙里放少量硫粉,加热,直到燃烧,观察硫在空气中燃烧时的现象。然后把燃烧匙伸入盛有氧气的集气瓶中,再观察实验现象。
实验4:把光亮的细铁丝绕成螺旋状,在空气中加热,观察实验现象。另取同样的铁丝,下端系一根火柴,点燃火柴,待火柴快要燃尽时,伸入盛有氧气的集气瓶中,观察实验现象。
实验5:点燃一根火柴,伸入到盛有氮气的集气瓶中,观察实验现象。
【问题】比较上述物质在空气、氧气和氮气里的燃烧现象有什么不同,你可以得出什么结论?
【结论】物质在空气中燃烧,实际上是与其中的氧气发生反应,由于空气中氧气含量相对较少,因此在空气中燃烧不如在氧气中剧烈。
【释疑】支持燃烧、助燃是一种通俗说法,氧气支持燃烧的本质是氧气与可燃物发生剧烈的化学反应,这些反应属于氧化反应,我们可以说碳、硫、铁等物质被氧气氧化。说明氧气的化学性质比较活泼,能够跟很多物质发生反应。
【思考与讨论】(1)铁丝在氧气中燃烧得到的黑色固体与铁在形态上很相似,如何说明这是生成的新物质,而不是熔成的铁珠呢?
(2)查阅资料可得,稀盐酸与铁反应有气体产生,可以把黑色固体放入稀盐酸中,若无气泡产生,则黑色固体是生成的新物质。
活动3:燃烧还需要其他条件吗?
【问题】通过前面的活动,同学们已经知道燃烧的发生需要可燃物,同时需要与空气(氧气)接触,那么除此之外,燃烧还需要其他条件吗?
【思考与讨论】请同学们分小组进行讨论:请回想秸秆、木柴、煤、汽油、天然气等常用燃料是如何被点燃的,分析燃烧还需要什么条件。
【实验探究】小组合作完成实验1~3,探究燃烧还需要什么条件。
实验1:向蒸发皿中加入酒精,点燃,观察酒精是否容易被点燃。
实验2:向燃烧匙中放一小块蜡,置于酒精灯上加热,观察何时蜡会燃烧。
实验3:点燃一根蜡烛,将铁丝网对折后(让铁丝网更细密)插入蜡烛火焰,观察现象。
(提示:铁丝网具有很好的导热功能)。
【归纳与总结】(1)燃烧还需要温度达到某个值。
(2)可燃物与氧气构成的反应体系升温,燃烧才会被引发。
(3)温度达到着火点也是燃烧的必要条件。
【问题与思考】实验3里铁丝网上方的火焰为什么会熄灭?
【讨论与交流】(1)铁丝网导热降温,使蜡烛火焰温度低于其着火点。
(2)不同物质的着火点不同,例如酒精是很容易被点燃的,而要点燃蜡烛就困难一些。
【拓展阅读】酒精灯和蜡烛结构的区别。
【思考与讨论】结合生活经验,请同学们思考:可燃物与氧气发生的反应一定都是燃烧吗?
【知识拓展】在某些条件下,物质与氧气的反应比较剧烈;而在另一些条件下,物质与氧气只发生缓慢的氧化反应。如果缓慢氧化放出的热积蓄的话,达到着火点就会发生自燃;但多数缓慢氧化只是放出热量,而不发生剧烈的燃烧现象。
【交流研讨】请同学们小组合作,解决下面三个问题:
问题1:根据前面的活动,归纳总结燃烧的条件。
问题2:思考这些条件之间是什么关系。
问题3:反思你从这个活动中学到的科学方法。
【思考与讨论】
问题1:燃烧需要三个条件——可燃物、氧气(空气)、着火点(达到燃烧所需的最低温度)。