聚焦课程思政 创新教学设计
作者: 傅雪青
《金属矿物的开发利用》是人教版高中化学必修二第八章第一节第一课时的内容,包含金属冶炼的原理、历史和方法等知识,是化学服务于生活的典型案例,蕴含着丰富的课程思政教育元素。
笔者从教学目标和学情入手,收集、整理课程思政教学素材,如《国宝档案》电视节目片段,人类冶金历史、相关古代诗词和典籍、金属铝冶炼的发展创新等文字材料,以及《矿物可供开采的年限图》《我国金属矿产资源分布地图》等,把政治认同、国家意识、文化自信、人格养成等思想政治教育元素融入教学中,使其与化合物、氧化还原反应原理、物质分类等知识的学习,以及归纳概括、分析总结、推理预测等能力的培养有机融合。
一、回望古代科技文明,在追溯冶金历史中发现化学规律
课堂上,笔者先引导学生阅读有关商后母戊鼎的材料并观看《国宝档案》相关视频片段。学生了解到商后母戊鼎是3000多年前的商王祖庚为祭祀其母戊所制的礼器,制作工艺极其复杂,是青铜器时代的杰作。接着,笔者用课件呈现历史上人类冶炼不同金属的大致年代表,并提问:人类掌握不同金属冶炼方法的顺序可能与什么因素有关?学生读表后发现,人类冶炼金、银、铜的最早时间在公元前4500年左右,冶炼铁的最早时间是公元前1500年左右,而冶炼活泼的铝、钠、钙、钾的时间均在十九世纪以后。这说明人类掌握不同金属冶炼方法的时间顺序与金属的活动性有关。由于学生在初中阶段已经学习了用焦炭不完全燃烧产生的一氧化碳还原赤铁矿炼铁的原理,学生讨论得出:越不活泼的金属越容易冶炼,出现的年代越早;金属越活泼,冶炼越困难,人类使用该金属的时间就越晚。还有的学生提出人类冶炼金属的先后顺序与金属在地壳中的含量、金属矿物的开采难度等有关,明确了人类掌握不同金属冶炼方法的顺序是多种因素综合作用的结果。
二、总结诗词古籍中的智慧,在冶金方法改进中感悟创新魅力
第二个教学环节,笔者先投影展示诗词、古籍中有关金属冶炼的四个材料:①唐代刘禹锡《浪淘沙》中的“千淘万漉虽辛苦,吹尽狂沙始到金”;②东晋葛洪《抱朴子》中的“丹砂烧之成水银”;③《宋史·食货志》中的“浸铜之法,以生铁煅成薄铁片,排置胆水槽中,浸渍数日,铁片为胆水所薄,上生赤煤”;④清代张泓《滇南新语》中的“炼矿曰扯铜,其法矿千斤用炭七八百斤不等,炉如夹墙,底作圆窠,铺以炭末,始加矿炭”。然后,学生分组讨论,解释上述材料中金属冶炼的方法,写出相关的化学方程式。学生借助已有知识,得出比较一致的认识:材料①说明金的密度比河砂大;材料②中的“丹砂”指硫化汞,描述的反应是“2HgS+3O2[高温]2HgO+2SO2,2HgO[高温]2Hg+O2”;材料③中“胆水”的主要成分应是硫酸铜溶液,描述的置换反应是“Fe+CuSO4[ ]FeSO4+Cu”;材料④描述的是用焦炭在高温下还原氧化铜的过程,即“C+CuO[高温]Cu+CO”。最后,学生在笔者引导下总结出金属冶炼的实质——寻找合适的还原剂将高价态的金属化合物还原为金属单质。
在此基础上,笔者用课件呈现文字材料“1827年,德国化学家维勒用氧化铝与干燥的氯气以及焦炭共热得到氯化铝,再用金属钾和无水氯化铝共热得到铝。1886年,美国大学生霍尔通过电解冰晶石—氧化铝熔融盐,成功将铝的冶炼温度从2050℃降低到950℃,使铝得以大规模生产”,以及包含离子化合物MgO、MgCl2、Na2O、NaCl、Al2O3的熔点和共价化合物AlCl3的熔点等信息的表格,引导学生走进金属冶炼方法的创新发展阶段。
学生在笔者引导下分析了维勒的制铝方法及其难以实现工业化生产的原因,以及霍尔电解法制铝的创新之处。学生提出,维勒的制铝方法需要使用氧化铝、干燥的氯气、焦炭、碱金属(钠或钾),主要反应分为两步[Al2O3+3C+3Cl2[高温]2AlCl3+3CO,3K+AlCl3(熔融)[高温]3KCl],并且需要高温加热;制备流程需要用到电解才能得到的氯气和碱金属,成本高,并且反应过程危险性高,所以无法实现工业化生产。
随后,笔者引导学生结合上述表格信息探讨:为什么冶炼钠、镁都是电解其熔融氯化物,冶炼铝却电解其熔融氧化物?电解氧化铝时加入冰晶石的作用是什么?学生经过比较和分析,发现Na、Mg、Al的氧化物熔点均远高于其氯化物,考虑到成本等因素,通过电解熔融NaCl、MgCl2制备Na和Mg是合理的;AlCl3共价性较强,熔融状态下很难电离出Al3+,所以只能通过电解熔融Al2O3制备Al。笔者补充戴维尝试采用电化学的方法从氧化铝中提取铝,但因氧化铝的熔点(2000℃以上)太高而失败的史料,引导学生进一步思考。学生得到以下结论:霍尔的创新之处是使用合适的助溶剂冰晶石(主要成分为NaAlF6)降低氧化铝的熔点,进而降低了金属铝的生产成本,使得铝可以实现大规模工业化生产。
借助上述材料,学生明确了金属冶炼需要综合考虑能耗成本,感悟到创新对推动人类文明和科技进步的重要作用,生发了热爱科学的情感。
三、从表象到本质,建构金属冶炼认知模型
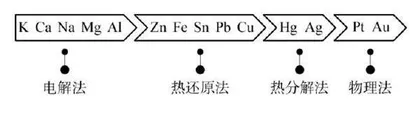
基于前两个教学环节中学生的已有认知,笔者提问:金属冶炼的本质是什么?金属冶炼方法与金属活泼性存在什么关系?你能发现其中的规律吗?学生阅读教材后,结合上述反应原理进行思考、讨论,形成以下认识。一是冶炼反应都是氧化还原反应,其本质是使金属矿物中化合态的金属得到电子,还原为游离态的金属单质。二是不同金属离子得电子能力不同。不活泼的金属,如Hg、Ag的离子得电子能力强,氧化性强,其化合物受热后容易分解得到金属单质,可用热分解法来冶炼;活泼的金属,如Na、Mg、Al的原子还原性强,采用一般的还原剂很难将它们从化合物中还原出来,工业上采用电解熔融金属化合物的方法得到金属单质;中等活泼的金属,如Fe、Cu等,需要加入还原剂(如C、CO、H2、活泼金属等),采用热还原法制备。最后,笔者引导学生依据金属活动性顺序,总结不同金属的冶炼方法,构建起金属冶炼方法的认知模型(如下图)。
四、借助真实信息,培养节约资源和可持续发展意识
在前面学习的基础上,笔者呈现《矿物可供开采的年限图》和《我国金属矿产资源分布地图》,让学生根据图片提供的信息谈谈启示。学生发现:金属资源的储量有限,分布不均匀,并且不能再生,而金属的开采和消耗速度是惊人的,金属的腐蚀造成了大量的损失。
为解决这些问题,笔者要求学生小组合作学习教材“思考与讨论”的内容。学生发现回收铝质饮料罐得到铝所消耗的能量要远远高于用铝土矿制铝所消耗的能量,进而认识到实际生产中必须考虑投入与产出。学生发现生产1kg铝需要消耗4kg铝土矿、0.5kg煤、0.25kg燃料油、0.5kg纯碱、0.5kg石灰、2kg氧化铝、0.04kg氟化钙、0.6kg焙烧碳素、0.03kg冰晶石以及至少16.5kW·h电,感受到生产1kg铝的消耗巨大。经过进一步讨论,学生找到以下开发与利用金属资源的途径:提高金属矿物的利用率;寻找金属的替代材料,减少金属的使用量;回收和利用废旧金属;开发环保、高效的金属冶炼方法等。这样教学,学生认识到金属矿物资源的有限性和合理利用金属矿物资源的必要性,树立了绿色化学观念和可持续发展意识,增强了社会责任感。