高中化学实验废弃物的处理研究
作者: 蔡敬华
[摘 要]文章介绍了现行高中化学教材中涉及的有毒有害实验废弃物的来源及其危害,对减少高中化学实验废弃物的产生提出了一些策略,以期为实现人类可持续发展做出应有的贡献。
[关键词]高中化学;实验废弃物;简易处理
[中图分类号] G633.8 [文献标识码] A [文章编号] 1674-6058(2024)08-0064-05
化学是一门以实验为基础的自然科学,实验在实现学科育人价值方面具有特殊功能。60%的现行初、高中化学教材知识由实验引入。同时,实验是研究化学物质及其变化的重要手段,在日常教学中组织多种实验探究活动,对于全面提升学生的学科素养有着极为重要的作用[1]。然而,在实验中产生的废气、废液、废渣大多含有毒有害物质,如果直接排放会造成环境污染,危害人体健康。故全国各地中小学化学实验产生的废弃物造成的聚沙成塔效应不容忽视。因此,采取适当的措施减少“三废”带来危害是非常必要的。
本文主要探讨高中化学实验废弃物的处理问题,从实验废弃物的来源、危害、处理方法及减少废弃物产生的方法等方面进行论述,并针对废气、废液和废渣总结多种处理方法,提出实现化学实验绿色化的策略,旨在降低“三废”的产生,实现更加环保的实验方式和废弃物处理方式。
一、实验废弃物的来源
按照《国家危险废物名录(2021年版)》《教学实验用危险固体、液体的使用与保管》(GB/T 28920—2012) 和《城镇污水处理厂污染物排放标准》(GB 18918—2002)的规定,我们查找了2017年人教版高中化学必修和选择性必修教材中的实验产生的有毒有害废弃物,了解了这些废弃物对环境和人体健康的危害,从而增强了防治污染、认真收集和处理废弃物的决心。
《国家危险废物名录(2021年版)》中明确将在生产、研究、环境检测等活动中,以及化学和生物实验中产生的含氰、氟、重金属的无机废液,废酸和废碱等物品列为危险废物,并定性为具有毒性、腐蚀性、易燃性和反应性。同时,也包括废液处理产生的残渣,含有机溶剂、甲醛的有机废液和沾染上述物质的实验用品、包装物、过滤吸附介质等[2]。被列为危险废物意味着它们需要特殊处理,以保护环境和人类的健康。
我校于2020年9月开始使用新教材,新、旧教材的实验内容变化不大,但新教材明确规定了学生必做实验,这为实验教学提供了一个基本标准,即学校必须安排学生独立完成必做实验,并在教学中严格遵守。另外,把课程内容与实验结合起来,对实验操作时间不长、过程简明易懂、能够展现明显现象的实验,也尽量让学生独立完成。
为落实立德树人根本任务,我校一贯重视实验教学,并根据课程标准开足、开齐学生实验和教师演示实验,认真开展“校本课程”“研究性学习”活动。这就造成了一定量实验废弃物的产生。但由于环保意识不强,理所当然地认为实验后的废弃物稀释后危害不大,实验产生的废弃物除少量回收利用、少量自然挥发外,大部分都进入了下水道。
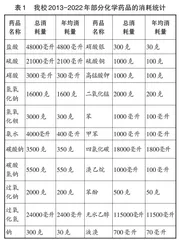
我校2013—2022年部分化学药品的消耗统计如表1所示。
二、实验废弃物的危害
(一)废气的危害
中学实验产生的废气,如SO2、NO2、H2S、NH3、C12等,会对人体健康造成危害。这些气体有刺激性,人体吸入后会引起呼吸道疾病并刺激眼角膜,严重时甚至会导致失明,吸入过多则可能导致窒息死亡。空气中存在超量的SO2、NO2等酸性气体时会形成酸雨。酸雨会腐蚀建筑物,阻碍植物的生长和发育,破坏生态系统中的营养元素循环;酸雨还会导致湖泊酸化,进而造成鱼类大量死亡。温室气体(包括但不限于CO2和CH4)的大量排放会导致全球气候变暖,给生态平衡带来破坏。
试剂挥发会产生多种有害废气,如HCl、Br2、苯及其同系物的蒸气,卤代烃蒸气,醛类蒸气和醇类蒸气等。这些气体具有刺激性和毒性。2017年10月27日,世界卫生组织国际癌症研究机构公布的致癌物清单中,苯和甲醛被列为1类致癌物, 四氯化碳被列为2类致癌物,甲苯、溴乙烷被列为3类致癌物。2019年7月23日,甲醛被列入有毒有害水污染物名录(第一批)。
(二)废液的危害
酸性废液和碱性废液倒入下水道会造成下水道系统腐蚀,导致管道破裂,污水外泄。这不仅影响到市政工程系统的正常运转,还会对土壤和地下水造成污染,导致土壤变成酸性或碱性,损害土壤结构,影响植物生长,进而威胁整个生态系统。
人们如果一次性大量摄入含有重金属离子的物质,会导致急性中毒,而长期少量多次地摄入,则可能导致人体畸形、致癌和基因突变。重金属一旦进入水体,很难被微生物降解,甚至会在微生物的作用下生成毒性更强的金属有机物。其中各种铬酸盐和Pb2+属于对环境极为危险的1类污染物,较高的铜浓度与癌症的形成有直接关系,食用可溶性钡盐会导致食道剧烈灼痛、恶心呕吐、腹痛不适等症状。
有机废液中主要的污染成分是有机溶剂,包括卤代烃、苯及其同系物、醇类以及醛类等。这些物质大多有毒,对人体健康有严重危害。例如,人饮用含有千分之几毫克甲醇的水就会导致眼睛失明;多氯代烃毒性极高且持久性强,可以经由食物链逐渐在生物体内富集,而且会通过母乳喂养传递给下一代;苯酚是一种强毒性物质,即使只有微量的排放也足以导致湖泊中的鱼类死亡。
(三)废渣的危害
废渣,即固体垃圾,是指在实验过程中多余的固体原料、反应生成的固体产物、过期的固体化学药品和破损的实验器皿等固体废弃物。这些成分复杂且浓度较高的固体废弃物如果被随意扔在垃圾堆中,经过日晒雨淋,其中的有害成分就会渗入土壤,导致地下水和土壤受到污染。部分固体废弃物还会被雨水冲进水体,造成水污染,农作物吸收了这类水体后也会被污染,从而危害人体健康。
三、实验废弃物的处理方法
(一)废气的处理方法
中学教学中,通常把实验过程中产生的有害气体的处理与该气体的制取和性质实验相结合,这方面的研究相对较多。教师和学生通常只重视对有毒尾气的处理,而对无毒气体如甲烷、二氧化碳等不太关注。然而,实际上这些无毒气体会导致温室效应。废气的处理方法主要有四种,分别是液体吸收法、燃烧法、物理吸附法和集中回收法。
1.液体吸收法
利用气体的特性,采用液体吸收尾气,再进行绿色处理以避免污染环境。通常用碱液吸收酸性气体,如在SO2性质实验中,多余的SO2可以用NaOH溶液处理;对于碱性气体,则可以用酸液吸收;对于某些容易溶于水的气体,如HCl、NH3等,则可以通过倒置漏斗直接用水来吸收。
2.燃烧法
一些无法通过溶液或水吸收的可燃性气体(如H2、CH4、C2H4、C2H2等),可以在实验装置末端添加尖嘴导管并点燃产生的尾气以去除污染。如果实验中产生的气体的量不足或间歇性产生,无法持续燃烧,可以将尾气导管的尖嘴放至酒精灯上方,使尾气充分燃烧。使用该方法时需注意检测尾气的纯度,以确保安全。
3.物理吸附法
药品室内有机试剂挥发所产生的废气,虽然浓度低,但长期滞留会威胁人体健康,排放又会对环境造成污染。为了解决这个问题,通常采用活性炭吸附法,利用活性炭的吸附特性,将低浓度的废气吸附到活性炭中,再对活性炭进行焚烧,最终达到去除污染的目的。通常把活性炭放进一种既防漏又透气的袋子里,再将袋子放入药品柜中。活性炭作为吸附剂,可以对烃类、卤代烃类、酮类、酯类、醇类、酚类等有机废气进行净化,其去除效率可达到95%[3]。
4.集中回收法
酒精灯燃烧用的工业酒精、乙醇试剂、用乙醇配制的酚酞试剂等挥发出的乙醇由于浓度较高,不适合用活性炭吸附法消除污染。这些试剂若长期不用应集中回收入细口瓶中,并存放在阴凉处,以减少因大量快速挥发带来的污染。以此类推,有挥发性的试剂(如氨水、盐酸、硝酸等),若较长时间不用都应集中回收入细口瓶中,密封保存,使用时用专用的滴瓶盛装,专管专用,这样基本不会造成污染。
(二)废液的处理方法
化学实验室排放的“三废”中对环境影响最大的是废液,因为废液的排放量最大。按成分划分,废液可分为无机废液、有机废液和有机无机混合废液三类。无机废液中的主要污染物包括废酸、废碱、含有重金属离子的盐类等,通常采用酸碱中和、混凝沉淀、还原反应等方法进行处理。有机废液中的有毒、有害物质包括苯、卤代烃、苯酚、醛类、醇类、酯类等,通常采用溶剂萃取、吸附、焚烧、氧化分解等方法进行处理,以减轻后续无害化处理的费用。
1.酸性废液、碱性废液的处理方法
实验后浓度较高的含酸或含碱的废液应分别收集,尽量再利用。如废酸可用于清洗附着碱性沉淀的试管和仪器,废碱可用于中和没有回收利用价值的废酸等,以达到以废治废的目的。无利用价值的低浓度酸、碱废液,应及时进行中和(中和后的pH范围在6.5~8.5),生成无毒性的盐类溶液后再排放。对于浓度极低的酸、碱废液(如酸碱中和滴定后的溶液),用水稀释到允许的范围内可直接排放。
2.重金属离子废液的处理方法
中学主要涉及的重金属离子有Cu2+、Ag+、Pb2+、Ba2+、Mn2+、Zn2+、各种铬离子,它们对人体和环境的危害极大。含重金属离子的废液不论浓度高低,必须全部回收。
(1)含Cu2+、Pb2+、Mn2+、Zn2+废液的处理
有很多重金属离子可以生成硫化物沉淀,且大部分金属硫化物的溶解度比氢氧化物低得多,因此利用硫化物沉淀可以更彻底地去除重金属离子。通常使用的沉淀剂有硫化钠、硫化钾和硫化铵等。处理重金属离子废液最有效的方法是在碱性环境下(pH为8~10)加入硫化钠,使其析出硫化物沉淀,再加入适量的铁盐作为絮凝剂,利用氢氧化铁的共沉淀作用,吸附重金属离子的同时去除多余的S2-;静置一昼夜再分离,先检查滤液中有无重金属离子,再检查滤液中有无S2-(因S2-在酸性环境中会生成剧毒的硫化氢)。含有S2-时,用H2O2将其氧化中和后再排放。废渣干燥后集中交给有资质的工厂进行无害化处理。
(2)含Ba2+废液的处理
在含Ba2+废液中加入Na2SO4溶液,转化为BaSO4沉淀,再静置过滤,将滤液直接排放,将滤渣进行回收处理,因为BaSO4是无害的钡盐。
(3)含Cr6+、Cr3+废液的处理
Cr6+是一种具有极强毒性的污染物,其在溶液中的浓度必须严格控制在5×10-5%以下。Cr6+可以在酸性或碱性条件下以铬酸根离子的稳定状态存在。因此,可以按照以下方法将Cr6+还原成Cr3+后进行中和,生成难溶的Cr(OH)3沉淀来去除[4]。①4H2CrO4+6NaHSO3+3H2SO4=2Cr2(SO4)3+3Na2SO4+10H2O,②Cr2(SO4)3+6NaOH=2Cr(OH)3↓+3Na2SO4。①式为还原反应,若pH值低于3会迅速结束;②式的中和反应需要调节溶液的pH值为7.5~8.5,以防止Cr(OH)3在pH值大于10时转变为[Cr(OH)4]-再溶解。反应后,需要静置、过滤并干燥废渣,然后将其交给有资质的工厂进行无害化处理;对于滤液须进行全铬检测(先用高锰酸钾将Cr3+氧化成Cr6+,再用二苯基碳酰二肼吸光光度法进行分析),确保滤液中没有铬后才能进行排放。
因无专门的检测设备,要做到含铬废液的达标排放在中学有一定的困难。高中化学学生实验中用到重铬酸钾的是“探究浓度对化学平衡的影响”实验,反应原理是:Cr2O[2-7]+H2O 2CrO[2-4] +2H+。该实验能充分证明增加或减少生成物浓度对化学平衡产生的影响,是非常经典的实验。如果试剂没有被污染,可以重复使用。因此,在课堂上教师要向学生说明铬的危害和处置难度,要求学生在实验中对含铬废液进行专门回收,调节溶液的pH值后重复进行使用,以减轻废液处置的工作量。