以大概念为统领的化学“变化观念与平衡思想”培育
作者: 毛志丹 周玉明
摘 要:“变化观念与平衡思想”核心素养,指向物质转化层次的高阶知识,能反映学生对物质变化与转化认识观念的系统认知。大概念向上能对接化学核心素养,向下能对接化学核心知识,在核心素养的培育过程中起到承上启下的桥梁作用。因此,教师应以大概念为统领,厘清伴随知识进阶的核心素养发展,建构概念层级体系。具体教学中,教师可用对立统一观点揭示核心概念的本质,用动态变化思想解决化学事实问题,用联系发展视角理解矛盾反应的内涵,逐步落实对核心素养的培育。
关键词:变化观念与平衡思想;大概念;核心素养;高中化学
《普通高中化学课程标准(2017年版2020年修订)》指出,高中化学教学要以大概念为核心,使课程内容结构化,促进核心素养培育的落实。“变化观念与平衡思想”是化学核心素养的重要组成部分,指向物质转化层次(动态水平)的高阶知识,要求围绕物质发生化学变化的条件、本质及规律,发展学生调控反应、解决实际问题的能力,能反映学生对物质变化与转化认识观念的系统认知。因此,笔者聚焦“变化观念与平衡思想”核心素养,以大概念为统领,试图厘清伴随知识进阶的核心素养发展,建构概念层级体系并探索核心素养培育策略,下面详细阐述。
一、厘清伴随知识进阶的核心素养发展
认识概念的本质及各概念间的关系,需要基于大概念建立合理的知识结构。用大概念对庞杂、零散的知识进行分类与分层,可实现教学内容的结构化或层级化,形成知识的意义整体。
(一)知识承载学科核心素养
核心素养的形成必定是由浅及深的,学习并掌握学科知识是必要条件。初中阶段,学生认识到化学变化有新物质生成,化学变化与物质本身的性质有关,化学反应需要一定条件并遵循一定的规律等。高中阶段,学生则有质的变化:从关注物质的变化和能量的变化发展到揭示变化的本质原因;从关注宏观现象到关注微观探析;从进行定性分析到进行定量研究。依据学生的认知、心理、社会性等方面的发展,课程标准设置与教科书编写都体现学习的连续性和进阶性,以适应不同学段学生的认知基础。教师要在教学中实现知识向核心素养的转化,彰显知识的功能价值。
(二)知识进阶与核心素养发展的联系
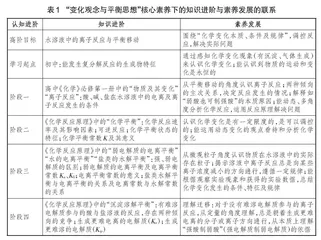
根据皮亚杰的认知发展观,笔者在尊重学生认知发展顺序的基础上,梳理“变化观念与平衡思想”核心素养下的认知发展进阶,将其分为四个阶段,建立化学学科知识进阶与核心素养发展的联系,具体如表1所示。
表1中,前一阶段为后一阶段作准备,后一阶段自然延伸前一阶段,每一阶段不可或缺,各阶段间不可逆转。
二、建构概念层级体系
能反映学科本质属性、居于学科核心地位的大概念具有广泛的解释力和预测性,其在内容上指向学科本质,在过程上强调渐次建构,在结论上注重理解与迁移,在深度学习上贯彻核心素养[1]。
(一)大概念的价值意蕴
学科核心素养需要用核心知识来“养”。通过传授化学学科的核心知识而让学生的核心素养发展起来,它们之间还需要一座连接的桥梁,即化学学科大概念[2]。这是因为化学学科大概念具有如下特点:其一,它是高阶与上位概念,向上能对接化学核心素养,向下能对接高中化学核心知识;其二,它是核心和深层次的统领概念,内藏核心素养的种子,外显核心知识的本质属性;其三,它是与时俱进的时代产物,既能将化学核心知识内化为化学核心素养,又能将化学核心素养外化为与生产生活密切联系的实践力量。因此,化学学科大概念在高中生提升化学核心素养方面起着关键作用。
(二)核心素养下的概念体系
基于对教材的深度理解是凝练大概念最直接、最重要的方法[3]。针对化学反应原理知识体系,学生需要形成“变化观念与平衡思想”核心素养。提及化学平衡,就必然要提及可逆反应。当反应可逆,才能形成化学平衡,也就是说化学反应可逆是化学平衡建立的前提条件。关于可逆反应的概念,高中化学教材中有不少“告知”性的表述,此类表述简单而抽象,容易使学生出现“生成不稳定物质的反应为可逆反应”的错误观念,不利于理解可逆反应的特征。教师可引导学生先运用反应历程示意图进行分析表征,不论是反应物还是生成物,其中的活化分子都能通过碰撞形成相同的过渡态,而过渡态既可以转化为生成物,也可以转化为反应物,表现为反应的可逆性,由此建构起“可逆反应同时向正、逆两个反应方向进行”的概念,再通过反应速率的动态变化表征,凝练出化学平衡这一核心概念。
化学平衡是由事实性知识、可逆反应等知识及小概念生成的一个核心概念,根据学科思想与方法,向上可提炼“化学变化是对立统一、动态变化、联系发展的”大概念,向下可分析、解决新的事实情境,横向发展并迁移出电离平衡、水解平衡与沉淀溶解平衡等核心概念。
一个完整的概念体系由许多子概念、核心概念组成。通过对教材中有关“平衡问题”内容的深度理解,厘清知识的产生与来源、作用与价值、本质与规律,可生成一系列子概念;通过对平衡本质、关系与结构的理解,可迁移衍生电离平衡、水解平衡、沉淀溶解平衡等一系列核心概念;而从定性、定量的学科思想与方法角度,可凝练“化学变化是对立统一、动态变化、联系发展的”大概念。由此,笔者建构了指向“变化观念与平衡思想”核心素养的概念层级体系(如图1所示)。
体系中的概念层级从反应事实、概念产生来源到学科思想与方法,由小到大,由低级到高级,数量众多。而落实在一堂课的教学中,大概念就是相对的,需要根据“表现性任务”来确定一堂课中最重要的大概念。
三、聚焦大概念的核心素养培育策略
素养与大概念既相关联也有区别,大概念是素养目标的内核,大概念是指理解了什么,而素养是指能做什么。素养在很大程度上是“做好”而不是“做完”,“做好”的前提是充分理解。教师应以大概念为桥梁,依托认知发展与知识(用教材教)进阶,培育学生的核心素养。
(一)用对立统一观点揭示核心概念的本质
矛盾揭示着事物间既“对立”又“统一”的关系。化学学科中蕴含着丰富的哲学观点,相互对立而又共存的概念很多,如可逆反应、化学反应的热效应、电解质的电离、沉淀与溶解等,具体分析如表2所示。化学变化中,旧化学键断裂和新化学键形成,反映了物质微粒间既对立又统一的关系[4]。利用哲学辩证思想认识微观角度下的化学变化,是渗透化学变化本质的良好途径。在可逆反应中形成的动态平衡,指微观角度下正、逆反应速率相等,即反应物分子中化学键断裂的速率与其生成物分子中化学键生成的速率相等。深入微观,利用对立统一的观点,有助于学生形成平衡观念(理解),并用对立统一的观点更好地解决问题(做好)。
从辩证唯物主义哲学视角分析、领悟化学变化而形成的变化观念,是科学观念,亦是科学思想。通过对化学基本概念的本质理解,学生可内化“化学变化是对立统一的”概念。
(二)用动态变化思想解决化学事实问题
化学平衡状态,就是对立着的双方(正反应和逆反应)在维持条件不变时势力相当的临界状态。当条件改变时,有利于其中的一方而使其成为矛盾的主要方面,旧平衡就会被打破,然后在新的条件下,双方再次势均力敌达成新平衡。由此可见,化学平衡是动态的,并非固态的、静止不动的。可逆反应中,反应物和生成物是矛盾的双方,在不同条件下,可实现不同方向的转化。我们可利用动态变化思想,让平衡朝着有利于价值取向的方向发展,来解决实际问题。
健康人体体液pH通常稳定在7.35~7.45,呈弱碱性。只有在弱碱性条件下,细胞才可正常工作。一旦人体体液pH低于7.35就会引起酸中毒,表现为头晕甚至精神错乱等症状,但高于7.45又会引起碱中毒,表现为肌肉痉挛甚至引发心脏问题。对人体自身调节原理,我们可从溶解平衡与电离平衡角度分析CO2—H2CO3—[HCO-3]缓冲体系(H2O+CO2<I:\2023教学月刊社\2024年\2024教学参考\教学参考2024-1-2内芯\Image\image3.png>H2CO3<I:\2023教学月刊社\2024年\2024教学参考\教学参考2024-1-2内芯\Image\image3.png>[HCO-3]+H+)是如何维持体液正常的酸碱性的。人体代谢产生的酸进入血液时,H+与[HCO-3]反应,平衡向左移动,血液中溶解的CO2转变为气态的CO2从肺部呼出,维持pH基本不变;人体代谢产生的碱进入血液时,上述电离平衡向右移动,抑制pH升高,而血液中[HCO-3]浓度升高可由肾脏功能作用使其降低。此时,教师可提出问题:“对于临床表现中的酸中毒或碱中毒,为纠正酸碱失调,你可用哪些化学药物(口服或静脉注射)进行纠正?其纠正机理是什么?”
纠正酸中毒用NaHCO3,纠正机理是:[HCO-3]+H+<I:\2023教学月刊社\2024年\2024教学参考\教学参考2024-1-2内芯\Image\image3.png>H2CO3<I:\2023教学月刊社\2024年\2024教学参考\教学参考2024-1-2内芯\Image\image3.png>H2O+CO2(呼出体外)。纠正碱中毒用NH4Cl,纠正机理是:2NH4Cl+ CO2→(NH2)2CO(排出体外)+2HCl+H2O。
用动态变化思想针对具体反应调控反应条件,可实现平衡向有利于价值取向的方向移动。
动态变化思想在工业生产中有重要指导作用,也能用于解释生活中的一些现象或者指导我们解决一些具体问题。如工业上为定期除去锅炉水垢中的CaSO4,可用Na2CO3溶液进行处理,使CaSO4转化为疏松、易溶于酸的CaCO3沉淀,然后用酸除去。基于实际情境,利用动态变化思想解决化学事实问题,学生可内化“化学变化是动态变化的”概念。这能让学生在感受到化学学科实际价值的同时,认同化学对人类社会发展的促进作用,从而实现化学学科的社会价值。
(三)用联系发展视角理解矛盾反应的内涵
从指向“变化观念与平衡思想”核心素养的概念层级体系中也可看出,化学变化是联系发展的。例如,学生原有认知中已有Fe(OH)3能溶于酸溶液的认识,而Fe3+完全沉淀后的溶液pH为3左右(酸性),显然,从定性角度来看二者是一对矛盾。这就需要将定性的判断上升到定量的分析,根据Ksp[Fe(OH)3]=2.8×10-39,当c(Fe3+)≤10-5 mol·L-1时沉淀完全,此时溶液中c (OH-)≥10-11 mol·L-1,该溶液的pH约为3。
化学变化中存在着许多类似矛盾现象的反应,当从定性角度无法理解这些事实的矛盾时,必然需要发展到用定量来分析理解。抓住矛盾反应的表观特征与内涵的关系(如表3所示),有助于揭示问题本质。
同样,对于实验情境“CaCl2溶液能否鉴别Na2CO3与NaHCO3溶液”,依据原有认知进行猜测,会得出:可以鉴别两溶液,因为CaCO3难溶于水,Ca(HCO3)2易溶于水。而从定性实验来操作,两溶液均可能产生沉淀。猜测与事实出现矛盾,探究其原因,是在作定性理解时忽略了[HCO-3]也能电离产生[CO2-3],即NaHCO3溶液中也存在[CO2-3]。再结合CaCO3的Ksp深入理解,相同浓度的Na2CO3与NaHCO3溶液中,c([CO2-3])是不同的,结合滴定的思维方法,通过定量分析来鉴别Na2CO3与NaHCO3溶液是可行的。基于联系发展的视角呈现Na2CO3、NaHCO3溶液鉴别的发展路径,如图2所示。
<I:\2023教学月刊社\2024年\2024教学参考\教学参考2024-1-2内芯\Image\image2_2.pdf>图2 鉴别Na2CO3与NaHCO3溶液的联系发展路径
用联系发展的视角,将定性与定量相结合,解释矛盾反应的表观特征与内涵,学生可内化“化学变化是联系发展的”概念。
综上,笔者从平衡知识出发,提炼“化学变化是对立统一、动态变化、联系发展的”大概念,聚焦大概念来揭示核心概念的本质、理解矛盾反应的内涵、解决化学事实问题,从而有效地培育了学生的“变化观念与平衡思想”核心素养。[□][◢]
参考文献:
[1]陈宗荣.实施大概念学习 提升科学思维品质[J].福建基础教育研究,2022(4):20-23.
[2]伍春艳.提高高中学生化学学科核心素养的教学设计实践与研究[D].昆明:云南师范大学,2017:7.
[3]王强,李松林.学科大概念的剖析与建构:以物理学科为例[J].上海教育科研,2021(10):10-14.
[4]王英.从哲学视角看化学中的变化[J].中学化学教学参考,2017(11):17-19.