培养变化观念与平衡思想的高中化学项目式教学探究
作者: 王冬 李建娣
摘 要:项目式教学更强调以高阶知识带动低阶知识的学习,以高阶思维带动低阶思维的培养,可引导学生深度学习,发展高阶思维能力。在开展项目式教学时,教师要分析项目主题的核心知识及素养发展价值,建立知识层级框架,然后以此为指导,设计多样的任务、活动、问题,让学生亲历问题的解决过程,将学科核心知识、学科方法和学科思维进行结构化整合,促进对知识的整体建构。教师还要采用过程性与终结性相结合的评价方式,对学生的学习进行评价,帮助学生建立起分析、解决问题的思维模型,发展化学学科核心素养。
关键词:变化观念与平衡思想;项目式教学;高中化学
项目式教学是以建构主义理论为指导,将教学目标融入具体的学习任务中,利用项目活动中创设的驱动性问题,引导学生深度学习,发展高阶思维能力,达成培育学生学科核心素养的一种有效且可行的教学方式[1]。相比于传统课堂,项目式教学更强调以高阶知识带动低阶知识的学习,以高阶思维带动低阶思维的培养。项目式教学倡导学生综合利用所学知识解决陌生、复杂的问题,在项目实施过程中,学生必须调用结构化的学科知识与技能、学科思维方式以及学科领域所孕育的价值观念,形成能够进行迁移应用的解决一类问题的思路和模型,因此其在发展学生学科核心素养方面具有独特的价值[2]。下面,笔者以“合成氨的再认识”主题为例,阐述以项目式教学培养变化观念与平衡思想核心素养的实践。
一、项目式教学主题分析
(一)核心知识及素养发展价值
知识层面:化学平衡及其规律是高中化学教学的重点、难点,也是高考考查的热点,加深对化学平衡及其规律的认识和理解,建构结构化的认识思路,是教学的重中之重。“合成氨的再认识”项目式教学,将可逆反应的认识、可逆反应的证明、化学平衡状态的判断、化学反应限度的比较、化学平衡图像的绘制、化学平衡图像的分析、弱电解质的电离平衡、化学平衡的应用、化学平衡的规律等相关知识进行整合,让学生自主运用所学化学知识进行多角度分析与对比,发展解决实际问题的能力。它适用于高二年级人教版普通高中教科书《化学》选择性必修1第三章学完后的单元复习。
素养层面:通过学生活动,培养学生加工、处理信息的能力以及分析、解决问题的能力,发展学生变化观念与平衡思想核心素养。
(二)内容结构
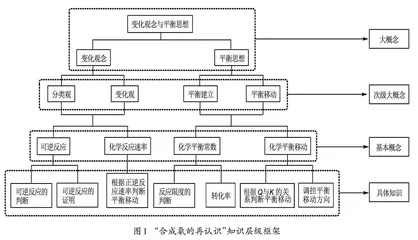
该项目教学过程突出变化观念与平衡思想核心素养的培养,具体的知识层级框架如图1所示[3]。
二、项目式教学的目标及任务
(一)教学目标
根据《普通高中化学课程标准(2017年版2020年修订)》的相关要求,笔者制订了如下教学目标。
(1)通过多角度介绍及实验证明可逆反应,深化学生对可逆反应本质的认识,培养学生的科学探究能力和严谨求实的科学态度。
(2)通过判断化学平衡状态及分析化学平衡图像,深化学生对化学平衡移动原理的认识,提升学生分析问题的能力。
(3)通过对化学平衡的迁移与拓展,发展学生的归纳综合能力,提升学生解决实际问题的能力。
(二)任务
依据项目式教学的特点及项目教学目标,笔者设计了4个不断进阶的学习任务,让学生亲历问题的解决过程。任务1是可逆反应的认识及证明,任务2是化学平衡状态的判断,任务3是化学平衡图像分析,任务4是化学平衡的迁移与拓展,下文将详细描述。
三、项目式教学的实施
笔者为整个“合成氨的再认识”项目式教学设计了一个总情境“向空气要面包——工业合成氨的原理”,并分任务进行教学,教学过程如下。
【任务1】可逆反应的认识及证明
[活动1]你能从哪几个角度认识合成氨是一个可逆反应?
生1:从反应物的转化率看,反应物不能完全转化为生成物,因此该反应是可逆反应。
生2:从正逆反应速率看,在相同条件下,正逆反应同时进行,因此该反应是可逆反应。
生3:可以看该反应的化学平衡常数,如果化学平衡常数较小,则该反应是可逆反应。
[活动2]合成氨反应是一个典型的可逆反应,那么我们该如何通过实验来证明一个反应是可逆反应呢?请大家以反应2Fe3++2I-[⇌]2Fe2++I2为例,设计实验方案证明该反应是可逆反应。
生4:取5 mL 0.1 mol·L-1 KI溶液于试管中,滴加0.1 mol·L-1 FeCl3溶液2 mL,反应完全后,取少量反应液,滴加AgNO3溶液,发现有黄色沉淀生成,证明反应物没有反应完全,进而证明该反应为可逆反应。
师:请大家评价这位同学的实验方案。
生5:该反应产物有I2生成,I2溶于水中也会生成I-,滴加AgNO3溶液也会产生黄色沉淀。
生6:从反应物的加入量来看,I-本身过量,即使该反应不可逆,滴加AgNO3溶液也会产生黄色沉淀。
生7:我觉得应该从该反应既有I2的生成又有Fe3+的剩余,来证明该反应是一个可逆反应。所以,可以取少量反应后的溶液,滴加淀粉溶液,若溶液变蓝,说明有I2的生成。另取少量反应后的溶液,滴加KSCN溶液,若溶液呈血红色,说明有Fe3+的剩余。
生8:也可以取少量反应后的溶液,加入少量CCl4,振荡,发现CCl4层显紫红色,证明有I2生成,再在上层溶液中滴加KSCN溶液,若溶液呈血红色,说明有Fe3+的剩余。
设计意图:通过活动1引导学生从多个角度认识可逆反应,加深对可逆反应的认识,深化对可逆反应本质的理解。通过活动2,让学生经历实验方案的设计、评价、完善等过程,提升学生的思维能力和探究能力。同时,这两个问题引发的学习活动又是开放性的,师生、生生可相互协商、交流、合作、对话,引发头脑风暴,从而将学生的思维引向深入,提升学生分析和解决问题的能力。
【任务2】化学平衡状态的判断
[活动1]可逆反应在一定条件下会达到平衡状态,对于合成氨(N2+3H2 [⇌]2NH3)反应,在恒温恒容条件下,下列哪些选项可以用来判断该反应达到平衡状态?
(1)体系压强不变;(2)气体密度不变;(3)体系温度不变;(4)v正(N2)=v逆(H2);(5)气体平均摩尔质量不变;(6)混合气体各百分含量不变;(7)一个N2分子生成的同时有两个NH3分子生成。
生9:(1)(3)(5)(6)(7)。
师:请解释(2)不能以及(5)可以的理由。
生9:[ρ=m(气体总质量)V(气体总体积)],在反应达到平衡的过程中m(气体总质量)不变,V(气体总体积)不变,则[ρ](气体密度)始终保持不变,所以,[ρ](气体密度)保持不变不能判断该反应已达到平衡状态。[M=m(气体总质量)n(气体总物质的量)] ,在反应达到平衡的过程中m(气体总质量)不变,n(气体总物质的量)在减少,因此,M(气体平均摩尔质量)在不断增大,所以,当M(气体平均摩尔质量)保持不变时,该反应已达到平衡状态。
[变式]若可逆反应为A(s)+2B(g)[⇌]C(g)+D(g),在恒温恒容条件下,(2)和(5)能否用来判断该反应达到平衡状态?
生9:可以(分析与上相似,此处略)。
[活动2]可逆反应在一定条件下可达到平衡状态,即达到了反应的限度,那么不同的可逆反应达到的限度相同吗?如何比较不同反应的限度大小?
生10:不同的可逆反应限度应该不同,可通过相同条件下化学平衡常数的大小或反应物的转化率大小进行比较。
[例题]在一固定容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)[⇌]2NH3(g)。隔一定时间对该容器内的物质进行分析,得到如表1所示的数据。
表1 时间、浓度对应表
[时间 / s 0 20 40 60 80 c(N2) / mol/L 0.2 c1 0.13 c3 c4 c(NH3) / mol/L 0 0.08 c2 0.16 0.16 ]
(1)该反应的平衡常数为____________;
(2)N2的平衡转化率为___________;
(3)温度升高,该反应的平衡常数将
______________(填升高、不变、下降);
(4)若加压,正逆反应速率如何变化?平衡常数呢?
设计意图:通过问题1及变式,让学生对比分析两个具有不同特点的可逆反应,加深对平衡状态判断依据的认识,解决判断平衡状态时的思维障碍。通过问题2让学生认识到不同的可逆反应有着不同的反应限度,将化学平衡常数及转化率引入反应限度的判断,把平衡问题由定性引向定量,使学生思考问题的方法更加丰富和严谨。
【任务3】化学平衡图像分析
[活动1]化学平衡的移动过程可以通过v-t图来表示,请大家画出合成氨反应N2(g)+3H2(g)[⇌]2NH3(g)在下列条件下的v-t图:一定温度下,合成氨反应达到平衡,t1时增加c(N2),t2时减少c(NH3),t3时增大压强,t4时升高温度,t5时使用催化剂。
生11:画出v-t图(略)。
[追问]在v-t图中可根据v正、v逆的相对大小判断平衡移动方向,判断平衡移动的方法还有哪些?
生12:还可利用勒夏特列原理以及Q与K的相对大小进行判断,Q>K平衡逆向移动,Q<K平衡正向移动,Q=K平衡不移动。
师:除了v-t图之外,还可用c-t图、w-p图来表示化学平衡的移动过程,请大家画出不同温度下(T1>T2),氨气浓度c-t图和氨气质量分数w-p图。
生13:画出图(略)。
[活动2]为研究温度对合成氨反应的影响,在某温度T1下,将一定量的N2和H2置于密闭容器中,在t时刻,测得容器中N2的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得N2的浓度,得到N2浓度先减小后增大的趋势图(略),请分析其原因。
生14:该反应是一个放热反应,T3之前该反应未达平衡,温度越高反应速率越快,时间越长转化的N2越多,所以N2浓度在不断减小;T3之后反应已达平衡,温度越高平衡越逆向移动,所以N2的浓度在不断增大。
设计意图:一方面,通过对化学反应速率与化学平衡问题的综合分析,让学生学会判断化学平衡移动的方法,更好地理解和掌握化学平衡移动的本质,学会形象地表达化学问题;另一方面,通过对图像问题的解读,进一步深化学生对化学反应速率、平衡问题的认识,加深学生对化学问题本质的理解,提升学生的思维能力。
【任务4】化学平衡的迁移与拓展
[活动1]将氨气通入水中,在一个开放的体系中能否建立起相应的化学平衡呢?
生15:氨气溶于水会生成一水合氨(NH3·H2O),NH3·H2O是弱碱,存在电离平衡:NH3·H2O[⇌]NH4++OH-,[Kb=cNH4+c(OH-)c(NH3·H2O)]。还存在水的电离平衡:H2O[⇌]H++OH-,Kw=c(H+)c(OH-)。
生16:应该还存在着氨气与水反应生成一水合氨(NH3·H2O)的可逆反应:NH3+H2O[⇌]NH3·H2O,[K=cNH3c(H2O)c(NH3·H2O)]。
[活动2]氨气溶于水的过程中存在三个平衡体系,分别是:NH3+H2O[⇌]NH3·H2O[⇌]NH4++OH-以及水的电离平衡。根据上述三个平衡体系,思考氨水溶液中存在哪些微粒。根据氨水中的平衡体系,能不能设计以氨水为原料制氨气的实验方法?