酸汤中产酸酵母的筛选及性能测定
作者: 潘宇 杨第芹 朱霞 叶雨 杨熟英
摘 要:产酸酵母作为酸汤发酵过程中的优势菌株,是影响酸汤产品品质的关键因素。本文通过形态学、生理生化和分子生物学,对从酸汤样品中分离出的产酸菌株进行鉴定,并测定分析其产酸、耐酸和耐胆盐能力。结果表明,RS-14为盔状毕赤酵母(Pichia galeiformis),CS-16和CS-19为膜醭毕赤酵母(Pichia membranaefaciens),45、RS-13、RS-15、CS-21和CS-22为满洲毕赤酵母(Pichia manshurica)。其中,菌株45的产酸能力最强,总酸含量达到41.47 g·L-1,且8株酵母菌均能在pH值为1.5和牛胆盐浓度为0.70%的条件下生长,具有较高的耐酸性能和耐牛胆盐性能。本研究通过对酸汤中产酸酵母的筛选及其性能测定,为开发酸汤纯种发酵菌株和提升酸汤发酵产品品质提供理论支撑。
关键词:酵母菌;酸汤;有机酸;耐胆盐
Abstract: Acid-producing yeast, as the dominant strain in the fermentation process of sour soup, is the key factor affecting the quality of sour soup products. In this paper, the acid-producing strains isolated from sour soup samples were identified by morphology, physiology, biochemistry and molecular biology, and their acid production, acid resistance and bile salt resistance were determined and analyzed. The results showed that RS-14 was Pichia galeiformis, CS-16 and CS-19 were Pichia membranacefaciens, and 45、RS-13、RS-15、CS-21 and CS-22 were Pichia manshurica. Among them, strain 45 has the strongest acid production capacity, with a total acid content of 41.47 g·L-1, and all 8 strains of yeast can grow under the conditions of pH 1.5 and bile salt concentration of 0.70%, with high acid and bile salt resistance. In this study, the screening and performance determination of acid-producing yeast in sour soup provided theoretical support for the development of pure fermentation strains of sour soup and the improvement of the quality of sour soup fermentation products.
Keywords: yeast; sour soup; organic acid; bile salt tolerance
酸汤作为贵州省黔东南苗族、侗族的传统发酵食品,深受当地消费者的喜爱。酸汤有多种类型,主要分为白酸汤和红酸汤等。传统的白酸汤主要以米汤(糯米或籼米)为原料,通过自然发酵制作而成[1];红酸汤主要是由红辣椒和红番茄再辅以一定量的调味料分别发酵后再按照一定比例混合发酵制作而成[2]。红酸汤是一种利用蔬菜自身附着的微生物或添加人工筛选的乳酸菌,在厌氧环境下发酵而成,深受消费者喜爱的特色风味食品。
在红、白酸汤发酵过程中,因发酵环境和地理环境不同,微生物菌群组成存在差异,但乳酸菌(Lactobacillaceae)和酵母菌(Saccharomycetaceae)作为发酵产品的共性优势菌,在酸汤发酵中发挥着重要作用[3]。何扬波等[4]探究出纳木雷氏乳杆菌(Lactobacillus namurensis)和戊糖乳杆菌(Lactobacillus pentosus)分别为辣椒酸汤和番茄酸汤的优势乳酸菌,汉逊德巴利酵母(Debaryomyces hansenii)和膜醭毕赤酵母(Pichia membranifaciens)分别为两种酸汤发酵后期的优势真菌。张璇[5]发现红酸汤中的微生物主要为酵母菌、乳酸菌和芽孢杆菌等。王琪琪等[6]研究结果表明,在白酸汤中,属水平上的乳杆菌属、毕赤酵母属和假丝酵母属等为优势菌属;辣椒红酸汤中酵母属、双足囊菌属和毕赤酵母属为优势真菌属;番茄红酸汤中哈萨克斯坦酵母属和毕赤酵母属为优势真菌属。石敏等[7]发现“凯里米酸汤”发酵中的主要菌群有乳杆菌和酵母菌等。综上,酵母菌在酸汤食品的发酵过程中起着至关重要的作用[8-9]。
贵州省黔东南地区酸汤发酵主要采用农家自酿法,通过自然发酵的方式进行酸汤制作。但这种发酵方式存在酸汤制作周期长、有效成分含量低、易受周围环境影响等问题,从而导致酸汤产品质量无法得到有效保障。吴茂钊等[10]筛选出副干酪乳酸杆菌G1-3(Lactobacillus paracasei)和印迪卡有孢圆酵母G2-2(Torulaspora indica),由两株菌复配发酵后制作的籼米白酸汤和糯米白酸汤中的总酸含量相较于自然发酵酸汤分别提高了5倍和18倍,且两株菌复配发酵后的白酸汤感官品质也优于自然发酵。胡悦等[11]将用乳酸菌发酵4 d的番茄酸汤和辣椒酸汤按1∶1复配后接种于用酵母菌ym1-3发酵4 d的红酸汤发酵体系中,结果发现,菌株生长情况良好,可应用于红酸汤强化发酵模式系统研究;肖甜甜等[12]从贵州传统特色民族食品苗家白酸汤中筛选出优势微生物乳酸菌和酵母菌,其中酿酒酵母YJ24菌株降糖率达72.84%,马克斯克鲁维酵母YJ1、曼氏毕赤酵母YX5菌株发酵产品感官得分较高。
当前,国内关于贵州黔东南酸汤的探究已涵盖多个维度,包括乳酸菌的特性探索、代谢产物与风味组分的分析、发酵流程的优化策略、营养价值评估、微生物群落多样性及其对酸汤质量的效应和对人体健康益处的探讨[13-20]。但在酵母菌的筛选、多元菌株共培养技术以及针对酸汤中醋酸菌与产酸酵母的产酸效能及耐酸特性方面的研究较少。本研究从贵州黔东南市面上及自制的酸汤样品中分离并遴选出产酸活性显著的菌株,并对产酸酵母的耐受力与产酸性能进行分析,旨在丰富红、白酸汤发酵工艺的微生物资源库,搭建酸汤产酸微生物数据库,以期为食品企业制作高质量酸汤提供科学依据与菌种资源。
1 材料与方法
1.1 材料与试剂
自制白酸汤、苗吴记白酸汤、红酸汤,贵州苗吴记食品科技有限责任公司;氯化钠、碳酸钙和氢氧化钠,均为分析纯,国药集团化学试剂有限公司;无水葡萄糖,上海麦克林生化科技股份有限公司。
1.2 仪器与设备
全自动微生物生长曲线分析仪RTS-1C,北京立信宏达科技有限责任公司;医用离心机,湖南平凡科技有限公司;自动菌落计数仪,上海磐麦科技有限公司;pH计,上海仪电科学仪器有限公司;高压蒸汽灭菌锅,致微(厦门)仪器有限公司。
1.3 培养基制备
YPD培养基(100 mL):葡萄糖2 g,蛋白胨1 g,酵母浸出粉0.5 g,琼脂2 g,自然pH值;酵母菌产酸筛选培养基(100 mL):在YPD培养基中添加CaCO3 1 g,琼脂2 g;碳源同化试验基础培养基(100 mL):(NH4)2SO4 0.50 g,KH2PO4 0.10 g,MgSO4 0.05 g,CaCl2 0.01 g,NaCl 0.01 g,酵母膏0.02 g,其他碳源2 g;氮源同化试验基础培养基(100 mL):葡萄糖2 g,MgSO4 0.05 g,酵母膏0.02 g,KH2PO4 0.1 g;产类淀粉化合物培养基(100 mL):KH2PO4 0.10 g,(NH4)2SO4 0.50 g,MgSO4 0.05 g,CaCl2 0.01 g,NaCl 0.01 g,酵母膏0.1 g,葡萄糖3 g。
1.4 实验方法
1.4.1 产酸菌株的筛选
从凯里酸汤样品中称取1 mL新鲜样品加入50 mL灭菌离心管中,加入无菌水9 mL,于30 ℃、180 r·min-1摇床中振荡30 min,制成悬浮液。取100 μL接种于10 mL的YPD培养基中,于30 ℃、160 r·min-1的摇床中振荡培养2 d。将培养液稀释至10-4、10-5、10-6后,取各稀释度培养液100 μL,涂布于含1%碳酸钙的YPD培养基上,置于30 ℃恒温箱中培养72 h,挑选并保存具有不同形态特征的单一菌落菌株。
1.4.2 菌株鉴定和构建系统发育树
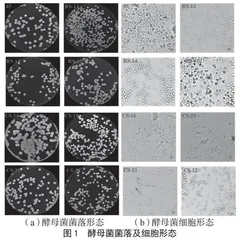
(1)形态学鉴定。将筛选得到的酵母菌株接种至YPD固体培养基上,于30 ℃培养箱培养2 d,观察并记录单个菌落形态。用接种环挑取单个菌落,均匀涂布于载玻片上,在光学显微镜下进行细胞形态观察[21]。
(2)生理生化实验。菌株糖发酵、碳源同化(麦芽糖、葡萄糖、果糖、蔗糖、乳糖、可溶性淀粉和甘露醇)和氮源同化(蛋白胨、酵母膏、尿素、牛肉膏和硫酸铵)实验等参照《酵母菌的特征与鉴定手册》,用于检验菌株对各种糖发酵、碳源及氮源的利用情况,并记录结果[22]。
(3)分子生物学鉴定。采用DNA提取试剂盒对酵母DNA进行提取。以提取的酵母DNA为模板,以26S rRNA基因通用引物NL1(5’ -GCATATCAATAAGCGGAAAAG-3’)和NL4(5’ -GGTCCGTGTTTCAAGACGG-3’)为上下游引物,进行26S rDNA片段聚合酶链式反应(Po1ymerase Chain Reaction,PCR),而后将PCR扩增产物送至南京擎科生物有限公司测序,所得基因序列提交至NCBI数据库中进行BLAST同源性对比分析,选取同源性高的序列,用邻近法构建系统进化发育树。
1.4.3 菌株的产酸特性
接种1%菌悬液于YPD培养基中,空白组不接菌,然后将两组平板同时置于30 ℃培养箱中培养48 h,发酵液总酸度根据《食品安全国家标准 食品中总酸的测定》(GB 12456—2021)中的酸碱指示剂滴定法对样品进行测定,发酵液pH值依据《食品安全国家标准 食品pH值的测定》(GB 5009.237—2016)进行测定,每组重复3次。
1.4.4 耐酸、耐胆盐性能评价
(1)耐酸性能评价。按照2%接种量将活化的酵母菌种子液分别接种到pH值为1.0、1.5、2.5和3.5的生理盐水中,于37 ℃培养0 h、3 h后用平板计数法测定活菌数,每组重复3次,以不调节pH值的生理盐水作为对照。
(2)耐牛胆盐性能评价。按照2%接种量将活化的酵母菌种子液分别接种至牛胆盐含量为0%、0.03%、0.10%、0.30%、0.50%和0.70%的生理盐水中,于37 ℃培养0 h、4 h后用平板计数法测定活菌数,每组重复3次,以未加牛胆盐的生理盐水作为对照。酵母菌存活率计算公式为
n=A1/A2×100%(1)
式中:n表示存活率,%;A1表示盐酸处理3 h或牛胆盐处理4 h后的最终活菌数,CFU·mL-1;A2表示盐酸或牛胆盐处理处理0 h时的活菌数,CFU·mL-1。
2 结果与分析
2.1 产酸酵母菌的分离
将从YPD筛选培养基中分离纯化得到的23株酵母菌进行产酸能力测定。结果表明,有8株酵母菌具有较好的产酸效果,并将其分别命名为45、RS-13、RS-14、RS-15、CS-16、CS-19、CS-21和CS-22。8株酵母菌在YPD固体培养基上生长72 h后,细胞形态和菌落形态见图1。