高效液相色谱法测定湿米粉中米酵菌酸和毒黄素含量的不确定评定
作者: 陈嘉聪 温晓裕 李嫚
摘 要:目的:高效液相色谱法测定湿米粉中米酵菌酸和毒黄素含量的不确定度。方法:通过建立数学模型,分析测定过程中的不确定度来源。结果:毒黄素的测定结果为(7.17±0.24) μg·mL-1,米酵菌酸的测定结果为(7.10±0.25) μg·mL-1。结论:该方法主要不确定来源为标准溶液配制过程和样品定容体积,提示样品检测过程中需对这两个方面进行严格控制,以提高检测数据的准确性。
关键词:毒黄素;米酵菌酸;高效液相色谱法;不确定度评定
Uncertainty Assessment of Bongkrecic Acid and Toxoflavin Content Determination in Wet Rice Noodles by High-Performance Liquid Chromatography
CHEN Jiacong, WEN Xiaoyu, LI Man
(Huizhou Institute for Food and Drug Control, Huizhou 516000, China)
Abstract: Objective: To determine the uncertainty of rice yeast acid and toxoflavin in wet rice flour by HPLC. Method: The source of uncertainty was analyzed by establishing mathematical model. Result: The results of toxoflavin and rice yeast were (7.17±0.24) μg·mL-1 and (7.10±0.25) μg·mL-1 respectively. Conclusion: The main source of uncertainty in this method are the standard solution preparation process and the constant volume of the sample, which suggests that these two aspects should be strictly controlled in the process of sample detection to improve the accuracy of detection data.
Keywords: toxoflavin; bongkrekic acid; high performance liquid chromatography; uncertainty evaluation
毒黄素(Toxoflavin,TF)和米酵菌酸(Bongkrekic Acid,BA)是由椰毒假单胞菌属酵米面亚种在适宜温度、湿度等条件下产生的两种毒素。毒理学研究表明,BA对小鼠静脉注射的LD50为1.14 mg·kg-1、MED50为0.056 2 mg·kg-1[1],TF对小鼠静脉注射的LD50为1.7 mg·kg-1,MED50为8.39 mg·kg-1[2-3]。其中,米酵菌酸耐热,一般烹调方法不能将其去除,这也是由椰酵假单胞菌引起食物中毒导致病死率高的主要原因之一。为了提升毒黄素和米酵菌酸的发现率,本文采用《食品中毒黄素和米酵菌酸含量测定 高效液相色谱法》(T/HZBX 35—2021)[4]进行分析,然而,任何检测方法的准确性和可靠性都受到多种因素的影响,包括人员操作、试剂质量、仪器精度以及环境条件等[5]。因此,对检测方法进行全面的不确定度评定显得尤为重要。本文依据《测量不确定度评定与表示》(JJF 1059.1—2012)[6]及《化学分析中不确定度的评估指南》(CNAS—GL006:2019)[7],对《食品中毒黄素和米酵菌酸含量测定-高效液相色谱法》[4]的检测方法进行系统的不确定度评估,了解检测结果的准确性和可靠性,进而提升实验室的质量控制水平,并为食品安全监管部门提供科学依据,为保障公众健康贡献力量。
1 材料与方法
1.1 主要材料与试剂
毒黄素(CAS号:84-82-2,纯度≥98%)、米酵菌酸(CAS号:11076-19-0,纯度≥95%)、甲醇(色谱纯)、乙腈(色谱纯)和QuEChERS dSPE EMR-Lipid,广州安捷伦科技有限公司;Polish Tube-NaCl/MgSO4,广州安捷伦科技有限公司;dSPE Cleaneup Tubes(成分配比:300 mg MgSO4、100 mg PSA和100 mg C18;容量:15 mL),上海安谱实验科技股份有限公司;Cleanert MAS-Q(成分配比:PSA 400 mg、C18 400 mg和MgSO4 1.2 g;容量:15 mL),天津博纳艾杰尔科技有限公司;超纯水。
1.2 主要仪器与设备
Agilent 1260高效液相色谱仪配DAD检测器,美国安捷伦公司;梅特勒XS205电子天平;GT-2227QTS智能超声波清洗仪,广东固特超声股份有限公司;Fotector Plus高通量全自动固相萃取仪,厦门睿科集团股份有限公司。
1.3 实验方法
1.3.1 标准溶液配制
(1)米酵菌酸标准储备液(0.1 mg·mL-1)。准确称取米酵菌酸标准品10 mg,用甲醇溶解并转移至100 mL容量瓶中,用甲醇定容至刻度线,摇匀备用。
(2)毒黄素标准储备液(0.1 mg·mL-1)。准确称取毒黄素标准品10 mg,用甲醇溶解并转移至100 mL容量瓶中,用甲醇定容至刻度线,摇匀备用。
(3)标准系列工作液。分别吸取0.5、1.0、2.0、5.0、10.0 mL和25.0 mL米酵菌酸和毒黄素标准储备溶液,用甲醇稀释并定容至100 mL容量瓶中,依次配制成浓度为0.5、1.0、2.0、5.0、10.0 µg·mL-1和25.0 µg·mL-1的标准系列工作液,临用时配制。
1.3.2 样品前处理方法
称取粉碎/混匀的试样2 g于50 mL塑料离心管中,加入80%甲醇10 mL,涡旋混合2 min,超声处理10 min,然后以5 000 r·min-1的速率离心5 min。吸取上清液至预装dSPE EMR-Lipid吸附剂的离心管中,涡旋混合2 min,再次以5 000 r·min-1的速率离心5 min。取上清液于氮吹管中,重复上述提取、净化步骤,合并上清液。将合并后的上清液于40 ℃水浴中氮吹至体积小于1 mL,用甲醇定容至1 mL,经0.22 μm滤膜过滤后待测。
1.3.3 色谱条件
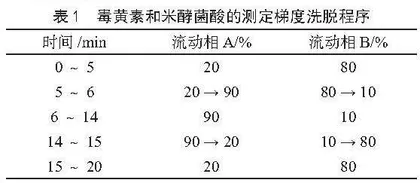
色谱柱:C18色谱柱(250 mm×4.6 mm,5 μm);流动相A:甲醇;流动相B:水(甲酸调节pH值至3.0);流速:1 mL·min-1;检测波长:258 nm;柱温:30 ℃;进样量:10 µL,梯度洗脱程序见表1。
1.3.4 试样溶液的测定
以标准工作液浓度为横坐标,以高效液相色谱仪响应对应的峰面积为纵坐标,绘制标准曲线。用高效液相色谱仪对试样溶液进行测定,得到相应的峰面积,根据标准曲线计算试样溶液中毒黄素和米酵菌酸的浓度。
2 结果与分析
2.1 数学模型及不确定度来源分析
2.1.1 数学模型
根据食品中毒黄素和米酵菌酸含量测定-高效液相色谱法,毒黄素和米酵菌酸含量的计算公式为
(1)
式中:X为试样中被测物的含量,mg·kg-1;C为从标准曲线得到待测液中目标物的浓度,µg·mL-1;I为试样溶液定容体积,mL;m为试样质量,g;1 000为单位换算系数。
毒黄素和米酵菌酸含量测定过程中,引入测量重复性影响因素的修正因子N,故将式(1)改写为式(2),即
(2)
式中:N为测量重复性影响因素的修正因子,N=1,输入量C、I、m和N互不相关,且X的计算公式只有输入量C、I、m的积和商形式,因而用简化的方式计算相对合成标准不确定度[8]为
(3)
2.1.2 不确定来源分析
根据测定过程,高效液相色谱法测定食品中毒黄素和米酵菌酸含量过程中引入的各不确定度分量及其表示符号见表2[9]。
2.2 不确定度评定
2.2.1 样品溶液配制引入的相对标准不确定度urel(C)
样品溶液配制引入的相对标准不确定度urel(C)包括4个来源[10]。①标准溶液配制过程中标准品纯度引入的相对标准不确定度urel(P);②标准品称量引入的相对标准不确定度urel(M);③标准溶液配制过程引入的相对标准不确定度urel(V);④校准曲线拟合引入的相对标准不确定度urel(A)。
(1)标准品纯度引入的相对标准不确定度urel(P)。毒黄素和米酵菌酸证书上显示含量分别为98.00%、95.00%,未明示其不确定度。本文以其真值在±0.05%区间内分布,按不确定度的B类评定方法[11],矩形分布,则毒黄素标准品引入的相对标准不确定度为
米酵菌酸标准品引入的相对标准不确定度为
(2)标准品称量引入的相对标准不确定度urel(M)。标准物质称量采用十万分之一天平,电子天平经检定合格,由检定证书可知称量重复性误差为0.03 mg,示值误差0.01 mg;天平按B类不确定度评定方法,取矩形(均匀)分布,k=。
则重复性误差引入的标准不确定度为
天平示值误差引入的标准不确定度为
实验中称量采用减重法,包括去皮和放样两次操作,这两次称量是相互独立的,所以标准品称量引入的标准不确定度为
标准品质量MR=10 mg。则标准品称量引入的相对标准不确定度为
(3)标准溶液配制过程引入的相对标准不确定度urel(V)。标准曲线配制过程中,使用100 mL容量瓶、1 mL移液器和2、5、10、25 mL A级单标移液管。其标准不确定度主要来源于容量瓶、移液器的校准和温度影响。产品信息表明,容量瓶、移液器已在20 ℃校准,而实验室的温度一般在±5 ℃之间变化[12],引起的不确定度可通过温度范围和体积膨胀系数进行计算,过程中主要考虑液体的体积膨胀。已知甲醇体积膨胀系数为1.2×10-3 ℃-1,服从矩形分布(k=)。则由温度影响产生的允许误差为(V×∆T×1.2×10-3),容量瓶、移液器分别服从三角形分布(k=)、矩形分布(k=),根据其容量允差(a),参考《移液器检定规程》(JJG 646—2006)[13]、《常用玻璃量器检定规程》(JJG 196—2006)[14]要求,由标准溶液配制过程中引入的相对标准不确定度见表3。
则标准溶液配制过程引入的相对标准不确定度为
(4)校准曲线拟合引入的相对标准不确定度urel(A)。毒黄素和米酵菌酸的标准工作液包含6个质量浓度点,每个质量浓度点分别进样2次,以色谱峰面积的平均值(表4)为纵坐标(Y),以工作液质量浓度(X)为横坐标,线性回归方程Y=AX+B,用最小二乘法拟合,数据结果见表5。标准工作溶液质量浓度为横坐标拟合标准曲线方程Y=AX+B(A为斜率,B为截距)及相关系数(R2),根据贝塞尔公式[15-16],按式(4)~式(6)计算校准曲线拟合引入的相对标准不确定度urel(A),结果如表5所示。