番茄源糖基转移酶UGTSL2的重组表达及其诱导条件优化
作者: 詹依雅 夏菠
摘 要:来自甜叶菊叶片的莱鲍迪苷D因其高甜度、低热量被认为是理想的天然甜味剂,又因其产量少、相关合成酶可溶性表达水平低而限制其应用。糖基转移酶SL2能将天然产量高但苦味重的莱鲍迪苷A转化为天然产量低但苦味少的莱鲍迪苷D。本研究克隆番茄来源莱鲍迪苷D相关合成酶UGTSL2基因,在大肠杆菌BL21(DE3)中进行重组表达,并通过单因素试验探究提高可溶性重组酶的表达水平。结果表明,重组酶在诱导温度为16 ℃、IPTG浓度为0.05 mmol·L-1、诱导时间为28 h时,在大肠杆菌BL21(DE3)中可溶性表达量最大。利用高效液相色谱法对反应体系进行分析,表明重组酶能够将莱鲍迪苷A成功转化为应用价值更高的莱鲍迪苷D。研究结果为后续可溶性重组酶固定化应用合成莱鲍迪苷D奠定良好基础,也为合成价值更高的莱鲍迪苷M提供前提支持。
关键词:糖基转移酶;异源表达;生物转化;莱鲍迪苷D;莱鲍迪苷A
Recombinant Expression of Tomato-Derived Glycosyltransferase UGTSL2 and Optimization of Its Induction Conditions
ZHAN Yiya, XIA Bo
(College of Food Science and Technology, Hunan Agricultural University, Changsha 410128, China)
Abstract: Rebaudioside D from stevia leaves is considered to be an ideal natural sweetener due to its high sweetness and low calorie, and its application is limited due to its low yield and low soluble expression level of related synthetase. Glycosyltransferase SL2 can convert rebaudioside A with high natural yield but heavy bitterness into rebaudioside D with low natural yield but less bitterness. In this study, the UGTSL2 gene related to rebaudioside D from tomato was cloned and expressed in E.coli BL21 (DE3), and the expression level of soluble recombinase was improved by single factor experiment. The results showed that the soluble expression of the recombinant enzyme in E.coli BL21 (DE3) reached the maximum when the induction temperature was 16 ℃, the IPTG concentration was 0.05 mmol·L-1 and the induction time was 28 h. The analysis of the reaction system by high performance liquid chromatography showed that the recombinant enzyme could successfully convert rebaudioside A into rebaudioside D with higher application value. The research results lay a good foundation for the subsequent application of soluble recombinase immobilization to synthesize rebaudioside D, and also provide premise support for the synthesis of rebaudioside M with higher value.
Keywords: glycosyltransferase; heterologous expression; biotransformation; rebaudioside D; rebaudioside A
人体摄入过多的葡萄糖、果糖、蔗糖等高热量糖类,易引起肥胖、糖尿病、心脑血管病以及高血压等病症[1]。因此,寻找具有低热量和高甜度特性的天然甜味剂是当前主要的研究方向。目前,三氯蔗糖、安赛蜜、阿斯巴甜等人工甜味剂被广泛应用于食品加工业,虽然这些甜味剂成本低、甜度高,但过量食用会给身体带来潜在的健康风险[2-5],因此天然甜味剂越来越受到市场青睐。其中甜菊糖苷是天然甜味剂中最受欢迎的一种[6]。甜叶菊(Stevia rebaudiana Bertoni)是一种南美的灌木,也被称为“巴拉圭草”[7]。目前,研究者已从甜叶菊中提取出了60余种甜菊糖苷,其中含量最高的是甜菊糖和莱鲍迪苷A(Rebaudioside A,Reb A)[8],这两种物质也是市面上以“甜菊糖苷”命名的商品甜味剂的主要成分,此外还提取出了莱鲍迪苷D(Rebaudioside D,Reb D)、莱鲍迪苷M(Rebaudioside M,Reb M)以及甜菊双糖苷等[9]。甜菊糖苷具有高安全性、高甜度和高稳定性等优点[10-12],纯度不低于95%的甜菊糖苷可以作为甜味剂使用[13]。在多种甜菊糖苷中,Reb D和Reb M相较于市面上已经被商品化应用的Reb A和甜菊糖而言,具有甜度更高、回苦味更少以及口感更近似于蔗糖的优点,因此被认为是高热量糖的更理想替代品,具有更广阔的应用前景和更高的研究价值[14-15]。近年来,一些临床应用研究还证实了甜菊糖苷具有抗糖尿病、降血压、抗菌等多种保健作用[16]。因其强大的保健价值和甜味剂利用价值,甜菊糖苷的提取方法受到广泛研究,发现了多种新型提取及合成甜菊糖苷的方法,促进了甜菊糖苷的高效生产[17-18]。
莱鲍迪苷D和莱鲍迪苷M的主要合成方法是化学合成和生物合成[19]。QIAO等[20]通过多种糖基化反应的协同作用,完成了对甜叶菊叶片粗提物中甜菊醇的高效糖基化,成功合成了Reb A、Reb D以及Reb M。然而,化学法的步骤复杂且条件要求严苛,在合成过程中难以控制[21]。目前,研究者们侧重于研究用生物酶法催化合成莱鲍迪苷D和莱鲍迪苷M[22-27]。其中,利用糖基转移酶将Reb E转化为Reb D或利用糖基转移酶将Reb A转化为Reb D是合成莱鲍迪苷D的主要方法[28]。由于Reb E在甜叶菊中含量甚微,RebA是甜叶菊中的主要成分之一,因此研究RebA转化Reb D这条路径更为重要。WANG等[29]通过对甜叶菊基因组和转录组的分析,鉴定出甜叶菊来源糖基转移酶UGT91D2能将Reb A转化生成RebD。PRAKASH等[30]从番茄中鉴定出番茄来源糖基转移酶UGTSL2也能转化Reb A生成Reb D。WANG等[31]在水稻中也鉴定出具有催化Reb A合成Reb D活性的糖基转移酶EGUT11,并实现了酶基因在酿酒酵母系统中的异源重组表达。研究发现,Reb D合成的相关糖基转移酶的重组表达都存在可溶性蛋白表达量低的问题,进而影响重组酶在生物合成Reb D的活性,而大肠杆菌表达系统是应用最广泛的蛋白异源表达系统,因此,提高Reb D合成相关酶在大肠杆菌表达载体中的可溶性蛋白表达水平对后续的生物合成研究有重要的作用。
本研究将番茄来源的糖基转移酶SL2基因克隆导入至大肠杆菌BL21(DE3)中进行诱导表达,通过诱导时间、诱导温度、诱导剂异丙基-β-D-硫代半乳糖苷(Isopropyl β-D-Thiogalactopyranoside,IPTG)[32]浓度的优化,提高重组蛋白在大肠杆菌中的可溶性表达量。添加以二磷酸尿苷葡萄糖二钠盐(Uridine 5’-Diphosphoglucose Disodium Salt,UDP-G)为糖供体,利用重组蛋白将莱鲍迪苷A转化为莱鲍迪苷D,并采用高效液相色谱法验证重组酶的活性。研究结果为后续可溶性重组酶固定化应用研究合成莱鲍迪苷D奠定良好基础,也为合成价值更高的莱鲍迪苷M提供前提支持。
1 材料与方法
1.1 材料、试剂与仪器
感受态大肠杆菌BL21(DE3);甜菊双糖苷A标准品、甜菊糖苷D标准品,ChemFaces青岛君道生物技术有限公司;异丙基-β-D-硫代半乳糖苷(50 mg·mL-1)、氨苄青霉素(100 mg·mL-1)、SDS-PAGE蛋白上样缓冲液(5×),北京天根生化科技有限公司;二磷酸尿苷葡萄糖二钠盐,上海麦克林生化科技股份有限公司;PBS磷酸盐缓冲液(20×)、Tris-硼酸电泳缓冲液(10×),安徽雷根生物技术有限公司;PBS细菌蛋白制备裂解液,生工生物工程(上海)股份有限公司;30%Acr-Bic制胶液,北京索莱宝科技有限公司;四甲基乙二胺(TEMED)、磷酸(色谱级),天津市科密欧化学试剂有限公司;乙腈(色谱级),湖北弗顿科学技术有限公司;JY96-IIN超声破碎仪,宁波新芝生物科技股份有限公司。
1.2 糖基转移酶UGTSL2生物信息学分析
采用NCBI(https://www.ncbi.nlm.nih.gov/)对酶基因及基本信息进行检索,用ExPASy(https://web.expasy.org/compute_pi/)对蛋白质理化性质进行分析,SignalP 6.0(https://services.healthtech.dtu.dk/services/SignalP-6.0)进行信号肽预测,用InterPro(https://www.ebi.ac.uk/interpro/search/sequence/)进行结构域分析。
1.3 糖基转移酶UGTSL2的蛋白表达与纯化
1.3.1 重组糖基转移酶UGTSL2的表达载体构建
将检索得到的糖基转移酶UGTSL2基因交由生物公司构建克隆载体,该菌株内含有插入了目的蛋白基因的质粒pGBTNH2-SL2。利用质粒提取试剂盒提取出克隆载体中含有目的基因片段的质粒,送往上海生工生物工程股份有限公司进行测序。将5 μL测序正确的质粒加入50 μL感受态大肠杆菌BL21(DE3)中,轻弹混匀,冰浴30 min;然后在42 ℃金属浴中热击60~90 s,而后立即冰浴2~3 min,再向离心管中加入500 μL不含抗生素的LB液体培养基,混匀后放入37 ℃ 150 r·min-1的摇床中振荡复苏45 min。吸取100 μL菌液涂布于含有抗生素的LB固体培养基,37 ℃倒置培养1 d。挑取菌落摇瓶振荡培养后,取部分菌液送往上海生工进行测序。
1.3.2 重组UGTSL2的诱导表达
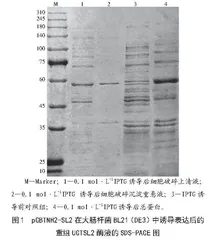
将表达菌株种子液按照3%的接种量转接到20 mL含有氨苄抗性的LB液体中,37 ℃振荡培养1.5~2.0 h至OD600达到0.5~0.6,取出100 μL作为诱导前对照,剩下的加入9.5 μL(0.1 mol·L-1)IPTG,28 ℃振荡培养诱导表达16 h。
1.3.3 重组UGTSL2粗酶液的获取
吸取10 mL含pGBTNH2-SL2的E.coli BL21(DE3)诱导后菌液,4 ℃ 10 000 r·min-1高速离心10 min,除去上清液,获取菌体;加入10 mL PBS细胞裂解液重悬胞体,冰浴条件下超声波破碎20 min(250 W、工作2 s、间隙6 s);破碎后的液体在4 ℃ 条件下以12 000 r·min-1高速离心10 min,收集上清液,获取粗酶液,用于后续可溶性蛋白表达量分析和活性检测。
1.3.4 重组UGTSL2的可溶性蛋白表达量分析
将粗酶液样品以及经过煮沸的诱导前全菌液对照分别与上样缓冲液(5×)按照4∶1的体积比混合,微速离心后采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium Dodecyl SulfatePolyacrylamide Gel Electrophoresis,SDS-PAGE)的方法观察洗脱蛋白的分子质量大小和纯度,其中分离胶浓度为10%,浓缩胶浓度为4%[33]。