茶皂素对肾癌细胞ACHN凋亡与迁移的机制研究
作者: 田迪 陈志云 吴冲 宋羚 赵英良 桂明英 马啸
摘 要:目的:探究肾癌细胞 ACHN 经不同浓度茶皂素(TS)组处理后,对细胞凋亡及迁移的影响及其相关机制。方法:以肾癌细胞ACHN为研究对象,在二甲基噻唑蓝比色法(MTT)细胞活性测定后,将细胞培养在含10%胎牛血清的高糖培养基中,分别用0、10、20、30 mg/L浓度的茶皂素处理细胞24 h。对细胞进行苏木精-伊红染色法(HE)、DAPI染色法(DAPI)观察不同茶皂素处理浓度时肾癌细胞的细胞形态及凋亡情况。划痕实验观察不同浓度茶皂素处理情况下细胞的迁移状况,蛋白免疫印迹法对调控细胞凋亡的蛋白,如Bax、Bcl-2、核转录因子-кB(NF-кB P53)、Caspase-9等与对细胞迁移有影响的基质金属蛋白酶-2(MMP-2)蛋白进行印迹分析。结果:在一定范围内,随着茶皂素处理浓度的增加肾癌细胞ACHN凋亡程度逐渐增大,对其迁移能力的抑制逐渐增加,对细胞凋亡有促进作用的Bax、P53、Caspase-9等蛋白的表达与无茶皂素处理组相比有增加趋势,而对细胞凋亡有抑制作用的蛋白Bcl-2表达则呈降低的趋势,促进细胞迁移的MMP-2蛋白表达也受到抑制。结论:茶皂素在肾癌治疗方面具有一定的潜在价值。
关键词:茶皂素;肾癌细胞;细胞活性;凋亡;机制
肾细胞癌又称肾癌,主要起源于肾小管上皮细胞,属于恶性肿瘤的一种,多发生于泌尿系统中,是成人肾脏中最常见的一种恶性疾病,且男性发病率远高于女性[1-4]。近年来,全球肾癌患者的数量以每年30万人的速度持续上涨[5]。目前,肾癌的主要治疗方法为手术切除和传统药物治疗[6]。尽管手术治疗效果较好,但是手术治疗也存在着复发率较高和早期转移的风险[7],而以白介素和干扰素为代表的传统免疫治疗在肾癌的治疗过程中不仅效率低而且还存在着较大的副作用[8],并且肾癌细胞对这些传统药物具有一定的耐药性。因此,研发出一种能更加有效抑制肾癌细胞增殖与迁移并且安全性较高、耐药性小的药物具有重要的意义。茶皂素又称茶皂甙,是茶叶的主要活性成分之一,属于齐墩果烷型五环三萜类皂苷的混合物,主要存在于茶树的种子中,除此之外在茶树的根、茎、叶和花中也有分布[9]。药理学研究发现,茶皂素具有多种药理活性,如抗炎、抑菌、降血脂、抗氧化和抗癌等[10-12],但目前有关茶皂素对癌症治疗方面的研究报道较少。研究发现,茶皂素可通过抑制Bcl-2蛋白表达,增加Bax蛋白表达,并活化Caspase-3蛋白的活性来诱导H22荷瘤小鼠肝瘤癌细胞凋亡[13]。因此,推测茶皂素对肾癌ACHN细胞的增殖与迁移也具有抑制作用。实验通过研究茶皂素对肾癌细胞ACHN凋亡与迁移的作用,通过细胞迁移、DAPI细胞核染色、对凋亡蛋白进行检测等试验,初步明确茶皂素对肾癌细胞ACHN增殖与迁移抑制的作用机制,为茶皂素对肾癌的抑制方面研究提供一定的依据。
1 材料与方法
1.1 材料与试剂
茶皂素,购自北京索莱宝科技有限公司;人肾癌细胞株ACHN,购自中科院昆明细胞库;MTT、DAPI,均购自Sigma公司;DMEM高塘培养基、胎牛血清、胰酶、青链霉素,购自美国Hyclone公司;Bax、Bcl-2、MMP-2、P53、Caspase-9、β-Tubulin等抗体,购自美国CST公司。
1.2 主要仪器设备
CO2培养箱;超净工作台;北京六一电泳仪;Thermo Fisher倒置显微镜;卢湘仪自动平衡离心机;低温高速离心机;Thermo Fisher高端酶标仪;蛋白荧光成像系统。
1.3 细胞培养
将肾癌ACHN细胞株按1×106个细胞/板的密度培养在100 mm直径培养皿中,在含10%牛血清的DMEM高糖培养基中保持生长,保持培养箱中含5%CO2,温度维持在37 ℃。当细胞生长到铺满培养皿底的90%~95%时对细胞进行处理。
1.4 MTT法检测肾癌细胞ACHN的存活率
将细胞以1×104个/孔的密度接种到96孔板中,分别为对照组和茶皂素处理组,茶皂素处理组浓度梯度为0、10、30、60、100 mg/L,设6组平行,避光培养24 h后,更换无血清培养基培养,加入浓度为3 mg/mL的MTT试剂20 μL,在5% CO2和37 ℃的条件下培养24 h后,除去培养基,加160 μL的DMSO在摇床上混合10 min后,在酶标仪上492 nm处测吸光度并按式(1)计算细胞存活率。
细胞存活率(%)=药物处理组的OD值/对照组的OD值×100%(1)
1.5 细胞划痕试验检测肾癌细胞ACHN的迁移能力
将处于对数生长期的细胞,采用3×105个细胞/板的密度接种到60 mm的培养皿中,在5%CO2,37 ℃的培养箱中培养10 h,待细胞铺满培养皿底部时,用200 μL的灭菌枪头在培养皿内划一条直线,用PBS清洗两次,洗去细胞碎渣,每皿加入4 mL的高糖培养基,分别用0(对照组)、10、20、30 mg/L的茶皂素处理。在5%CO2,37 ℃的培养箱中培养24 h,在倒置显微镜下观察细胞向划痕区迁移的相对距离并拍照,按式(2)计算细胞迁移率。每组设5个平行,取平均值。
迁移率(%)=给药组细胞迁移面积/对照组细胞迁移面积×100%(2)
1.6 细胞凋亡检测
将细胞按1×105个/孔的密度接种于事先放置爬片的12孔板上进行培养,待细胞均匀铺满爬片并贴壁生长后,加入0(对照组)、10、20、30 mg/L茶皂素处理24 h。处理结束后,用PBS清洗1次,多聚甲醛固定15 min后,将爬片放置事先滴有DAPI染液的载玻片上避光静置25 min,然后在荧光显微镜下进行观察拍照。设置3组平行。
1.7 HE染色
将细胞以4×105个/孔的密度接种于6孔板中进行分组培养,待细胞均匀铺满底部后加入0(对照组)、10、20、30 mg/L茶皂素处理24 h。对照组和给药组均采用无血清培养,处理结束后,用冷PBS清洗2次,按照说明书加入苏木精-伊红染料,然后在倒置显微镜下进行观察并拍照。
1.8 Western blot分析
将细胞以1×106个/板的密度接种于100 mm的培养皿中,待细胞贴壁生长后,加入不同浓度茶皂素处理24 h,弃去废液,用冷PBS清洗2次,每板加入270 μL的细胞裂解液(RIPA裂解液∶PMSF为100∶1)放入冰盒处理30 min后,刮下培养皿上的细胞及液体,设置离心机参数为4 ℃,15 000 r/min离心10 min,取上清进行BCA蛋白定量,根据定量结果进行制样,95 ℃煮样10 min。将样品逐一加入事先配制好的SDS-PAGE胶板中,设置电泳参数:第一阶段为50 V,30 min;第二阶段为120 V,70 min,随后转膜57 min。用5%脱脂乳粉封闭1 h后,加一抗在4 ℃冰箱过夜,然后用1xTBST洗膜3次,加二抗常温孵育1 h,1xTBST洗膜3次,曝光。
1.9 统计分析
试验数据取平均值,采用SPSS 17.0软件用单因素方差进行统计分析,蛋白印迹图像采用Image J软件进行处理分析,采用GraphPad prism 5软件作图(*P<0.05、**P<0.01、***P<0.001)。
2 结果与分析
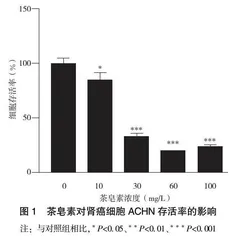
2.1 茶皂素对肾癌细胞ACHN存活率的影响
ACHN细胞经0、10、30、60、100 mg/L的茶皂素处理24 h后,用MTT检测细胞的存活率,如图1所示,与对照组相比,12.5 mg/L茶皂素处理组的ACHN细胞生长受到抑制,差异有统计学意义(P<0.05),且随着茶皂素浓度的增加这种抑制作用就越强(P<0.001),成浓度剂量依赖性,在50 mg/L时,ACHN细胞存活率降至最低(P<0.001)。茶皂素24 h的IC50值为25.38 mg/L。
2.2 茶皂素抑制肾癌细胞ACHN的迁移能力
为了减少茶皂素对细胞的毒副作用,分别采取0(空白对照组)、10、20、30 mg/L的茶皂素处理细胞,进行细胞迁移试验。如图2所示,随着茶皂素浓度的增加ACHN细胞迁移率逐渐降低,差异具有统计学意义(P<0.01)。划痕试验结果表明,茶皂素对肾癌ACHN细胞的迁移能力具有抑制作用,且迁移率呈浓度依赖性降低。
2.3 茶皂素促进肾癌细胞ACHN的凋亡
由图3可以观察出,随着茶皂素浓度的增加,细胞核的数量越来越少,表明肾癌细胞ACHN随茶皂素浓度的递增其凋亡的程度也逐渐增加。
2.4 HE染色结果
由图4可以看出,加入不同浓度的茶皂素处理24 h后,随着茶皂素浓度的增加,细胞核数量越来越少,并且细胞核体积整体出现增大的趋势。
2.5 茶皂素对Bax、Bcl-2、MMP-2、Caspase-9、P53蛋白表达的影响
凋亡是抑制癌细胞增殖的主要机制之一,Bcl-2基因家族主要调控着细胞的凋亡,包括抑凋亡基因Bcl-2和促凋亡基因Bax等,可通过抑制Bcl-2和促进Bax基因的表达来促进癌细胞的凋亡[14]。而P53则是Bax上游的一个十分重要的抑癌基因,该基因编码的蛋白可抑制肿瘤细胞的侵袭、增殖,在肿瘤血管的生成方面也发挥着有效的抑制作用[15]。因此,可通过激活P53基因的表达来抑制癌细胞的扩散并且促进其凋亡。细胞凋亡途径最终是通过激活Caspase家族成员,然后作用于基底蛋白,使其分解而引起凋亡[16]。Caspase-9作为肾癌细胞凋亡通路中的重要因子,是细胞凋亡的直接效应蛋白,可激活下游的细胞凋亡因子Cappase-3导致细胞凋亡[17],该凋亡通路可由Bax来激活[18]。研究发现,在肿瘤细胞中增加Caspase-9及其下游靶蛋白Caspase-3的蛋白表达水平,可以促进肿瘤细胞凋亡的发生[19]。癌细胞除了具有无限增殖的特点外,还有着极强的侵袭和迁移功能[20]。肿瘤细胞的侵袭是一个复杂的、多步骤的过程,其中细胞外基质和基底膜的降解是必需的步骤[21]。而MMP-2及其下游的MMP-9是降解细胞外基质的关键酶[22],对癌细胞的侵袭和转移具有促进作用[23],因此降低MMP-2和MMP-9的蛋白表达可使癌细胞的侵袭和迁移能力受到抑制,对癌症的预防及治疗具有重要的意义。与0 mg/L组对比,30、40 mg/L茶皂素处理组显著抑制了Bcl-2、MMP-2蛋白的表达,上调了Bax、P53、Caspase-9蛋白的表达。随着茶皂素浓度的增加,Bcl-2、MMP-2、MMP-9蛋白表达水平逐渐降低,而Bax、P53、Caspase-9蛋白表达水平则呈增高趋势,组间蛋白表达水平差异具有统计学意义(P<0.05、P<0.01)。
3 结论
肾癌的发生主要是由于细胞不能正常进行程序性死亡,进而表现为细胞的无限增殖。试验首先检测茶皂素对肾癌ACHN细胞活性的影响,在24 h内,茶皂素呈浓度依赖性地抑制了肾癌ACHN细胞的活性,可初步证实茶皂素具有体外抗肾癌ACHN细胞的活性。通过western blot可得,茶皂素对P53、Bax和Caspase-9蛋白表达水平均具有促进作用,对Bcl-2蛋白表达水平具有抑制作用,而细胞迁移试验结果表明,茶皂素对肾癌细胞ACHN的迁移具有抑制作用,且具有浓度依赖性。研究表明,茶皂素具有可抑制肾癌细胞ACHN的增殖和迁移的能力,能促进肾癌ACHN细胞的凋亡,其作用机制可能与Bax、Bcl-2、P53、MMP-2、Caspase-9等蛋白的表达有关,为茶皂素在抑癌方面的进一步开发奠定了一定的理论基础。
参考文献
[1]Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide:sources,methods and major patterns in Globocan 2012[J].Int J Cancer,2015,136(5):E359-E386.