术前营养炎症指标对胃癌患者生存的预后价值分析
作者: 原陈珊 李高鹏 王伟刚
摘 要:目的:探索术前营养炎症指标(预后营养指数PNI、系统免疫炎症指数SII、血小板与淋巴细胞比值PLR、中性粒细胞与淋巴细胞比值NLR、体质指数BMI)对胃癌患者生存状态的影响,为胃癌的防治提供科学依据。方法:回顾性分析2016年1—12月在山西省肿瘤医院初次诊断的胃癌患者的临床资料,计算患者术前PNI、SII、PLR、NLR、BMI。单因素生存分析采用Log-rank检验,多因素生存分析采用COX回归分析。结果:共有928例患者符合纳入标准。年龄最小者32岁,最大者88岁,平均年龄(63.69±9.27)岁。男性731例、女性197例。R语言“survminer”包确定各变量最佳截断值:年龄65岁、中性粒细胞3×109/L、淋巴细胞2×109/L、血小板314×109/L、白蛋白(ALB)41g/L、PNI 46、SII 531、PLR 187、NLR 2、BMI 20 kg/m2。单因素生存分析显示,年龄、中性粒细胞、淋巴细胞、血小板、ALB、PNI、SII、PLR、NLR、BMI有统计学意义。将这些变量纳入多因素COX回归模型后,结果显示,年龄(HR:0.778,95% CI:0.644~0.941)、ALB(0.762,95% CI:0.599~0.969)、PNI(HR:0.729,95% CI:0.540~0.984)、SII(HR:1.376,95% CI:1.131~1.676)、BMI(HR:0.724,95% CI:0.576~0.909)是胃癌患者生存的影响因素。结论:术前BMI、SII、PNI、ALB对胃癌患者生存有预测价值。术前营养状况会影响胃癌根治术后患者的5年生存状态。
关键词:胃癌根治术;生存分析;预后营养指数;系统免疫炎症指数;体质指数
在发病谱和死因谱上,胃癌均位居我国癌症新发和死因顺位第三位[1]。手术治疗是根治胃癌的有效手段之一。研究显示,预后营养指数(PNI)、系统免疫炎症指数(SII)、血小板与淋巴细胞比值(PLR)、中性粒细胞与淋巴细胞比值(NLR)对多种类型肿瘤的临床结局有一定的预测价值[2-4]。这类指数均由实验室常规指标运算得出,简单易行且不会增加患者的经济负担。因其在多种肿瘤的风险预测、临床诊断、预后评估等方面表现优于原始的单独指标,越来越受到临床医师的关注和重视。本研究通过分析术前营养炎症相关指标对胃癌患者生存率的影响,旨在探索其对胃癌患者生存的预测价值。
1 资料与方法
1.1 临床资料
回顾性分析2016年1—12月在山西省肿瘤医院住院的初治胃癌患者。通过查阅电子病历,整理患者临床资料,包括一般情况(住院号、性别、年龄、基础疾病、体格检查)、疾病资料(手术方式、手术时间、住院时间、有无并发症)和实验室检查结果,包括术前血清白蛋白(ALB)(g/L)、术前外周血淋巴细胞计数(×109/L)、术前血小板计数(×109/L)、术前中性粒细胞计数(×109/L)。
纳入标准:(1)行胃癌根治术。胃癌根治术包括:全胃、胃大部切除、食管胃连接处、贲门、幽门等涉及胃部的手术;(2)经病理证实为胃癌;(3)病例资料完整。排除标准:(1)合并其他部位恶性肿瘤者;(2)因梗阻、出血等原因行急诊手术者;(3)术后3个月内死亡者。本研究经山西省肿瘤医院伦理委员会审核批准(批准文号:2021JCⅡ12)。
1.2 患者随访
对所有患者进行电话和(或)门诊随访。随访截止日期为2021年12月31日。总生存(OS)时间定义从手术日期到因任何原因死亡或末次随访时间。
1.3 统计分析
各营养炎症指标计算公式如式(1)~(5)。使用SPSS 26.0和R4.1.1进行统计分析。使用R中“survminer” 包中的surv_cutpoint()函数来确定各个指标的最佳截断值。“rms”包绘制预测胃癌患者生存的nomogram图。单因素生存分析采用Log-rank检验,多因素分析采用COX比例风险回归模型。P<0.05认为差异有统计学意义。
预后营养指数(PNI)= 血清白蛋白水平(g/L)+ 5×外周血淋巴细胞计数(×109/L)(1)
系统免疫炎症指数(SII)= 血小板计数×中性粒细胞计数/淋巴细胞计数(2)
血小板与淋巴细胞比值(PLR )= 血小板计数/淋巴细胞计数(3)
中性粒细胞与淋巴细胞比值(NLR) = 中性粒细胞计数/淋巴细胞计数(4)
体质指数(BMI)= 体重(kg)/身高(m)2(5)
2 结果与分析
2.1 一般情况
共收集符合纳入及排除标准的患者928例,其中年龄最小者32岁、最大者88岁,平均年龄(63.69±9.27)岁。男性731例、女性197例,男女比例3.71∶1。
2.2 随访生存情况
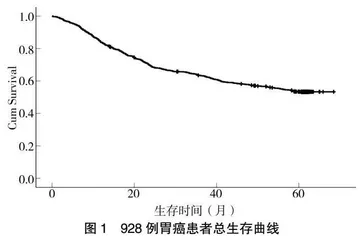
随访截至2021年12月31日,中位随访时间为60.57月,928例患者中,死亡431例、生存470例、失访27例,患者总生存率为53.6%(图1)。
2.3 最佳临界点选择
用R语言中“survminer”包确定各个指标的最佳截断值。为了方便临床使用,对R确定的最佳截断值进行四舍五入,用于后续生存分析(表1)。使用最佳截断值对各个变量进行分组。
2.4 单因素生存分析
单因素生存分析发现,年龄、中性粒细胞、淋巴细胞、血小板、ALB、PNI、SII、PLR、NLR、BMI差异均有统计学意义(P均<0.05)(表2)。
2.5 多因素生存分析
将以上单因素分析中有统计学意义的变量纳入到多因素COX回归模型中,使用向前法进行分析,结果显示,年龄≥65岁(HR = 0.778,95% CI:0.644~0.941),ALB≥41g/L(HR = 0.762,95% CI:0.599~0.969),PNI≥ 46(HR = 0.729,95% CI:0.540~0.984),BMI≥20 kg/m2(HR = 0.724,95% CI:0.576~0.90)均为影响胃癌患者生存的保护因素,SII ≥ 531(HR = 1.736,95% CI:1.131~1.676)是影响胃癌患者生存的危险因素(表3)。
2.6 术前营养炎症指标预测的胃癌患者生存nomo-gram图
为了使该模型具有较强的实用性,特绘制nomogram图,方便临床医师使用(图2)。将患者相关指标的得分总和,与模型总分进行比较,可以对患者的1年、3年、5年生存率进行预测。
3 讨论
3.1 术前营养状况影响胃癌根治术后患者5年生存状态
BMI是最常用的衡量营养状态的指标。研究显示,患者体重丢失量越大、BMI越低的患者生存期越短[5],本次研究显示,术前BMI≥20 kg/m2,患者5年生存期更长。ALB水平降低与预期寿命降低有关[6],本次研究ALB的最佳临界点是 41 g/L,ALB小于41 g/L会影响术后生存。PNI反映患者的免疫和营养状况。Li[2]等用Meta分析总结了25项研究共14 403名胃癌患者的术前PNI,结果显示,术前PNI低的患者有更高的术后并发症发生率和更高风险发生术后预后不良。术前营养状态可以被许多简单易得的指标反映,及时纠正营养问题,有助于改善术后生存。
3.2 术前炎症状态与营养状态相关联,影响患者术后生存
SII可以反应患者的炎症和免疫反应,用于多种类型肿瘤的预后研究,ZHAO等[3]对771名胃癌患者研究发现,术前SII是预后的独立危险因素。本研究也有同样发现,术前SII的增加表明预后更差。慢性炎症与营养不良又会导致白蛋白降低,而已有的炎症会因为手术而加剧,导致炎症加重,而营养治疗可以修复非脂肪组织、加快愈合,起到对抗炎症的作用[7]。另一篇关于PNI与胃癌术后生存分析的研究中发现,营养良好的胃癌患者的长期预后不受术后并发症的影响[8]。这说明营养状态良好虽然不能直接降低炎症反应,但改善营养状况有助于改善炎症带来的不良后果,营养良好的患者也许能够耐受术后并发症导致的一系列炎症变化,减轻并发症带来的负面影响。
3.3 在一定年龄范围内年龄因素可能不是危险因素
本研究中年龄≥65岁是保护因素,一方面与本次研究中65岁及以上患者居多有关。另外,本研究随访时间是5年,研究对象术后的生存期往往大于5年,若延长随访期,可能会有不同的结果。一项涉及老年(65~75岁)肝细胞癌(HCC)患者的研究发现,HCC生存的主要危险因素是SII≥610、肿瘤晚期以及终末期肝病模型(MELD)评分,与年龄无关[9]。在一定年龄范围的老年患者,年龄因素不一定是术后生存的危险因素。
4 结论
胃癌根治术患者术前BMI、SII、PNI、ALB均为影响术后生存有价值的预测指标。其中,BMI、SII、PNI、ALB均与人体的营养状况和炎症状态相关,可见术前的营养、炎症状况会影响术后5年的生存。对术前患者的营养与炎症状态的调整,可能对患者术后5年的生存产生影响,对临床工作很有应用价值。早期进行营养治疗改善营养状态,有机会延长患者的术后生存期。本研究不足之处:单一的机构研究,只分析了术前营养、炎症指标,术后随访的时间相对较短。
参考文献
[1]刘宗超,李哲轩,张阳,等.2020全球癌症统计报告解读[J].肿瘤综合治疗电子杂志,2021,7(2):1-14.
[2]LI J,XU R,HU D,et al.Prognostic nutritional index predicts outcomes of patients after gastrectomy for cancer:A systematic review and meta-analysis of nonrandomized studies[J].Nutrition and Cancer,2019,71(4):557-568.
[3]XU Z,CHEN X,AN J,et al.Correlation analysis between preoperative systemic immune inflammation index and prognosis of patients after radical gastric cancer surgery:based on propensity score matching method[J].World J Surg Oncol,2022,20(1):1-13.
[4]Ravindranathan D,Master V A,Bilen M A.Inflammatory markers in cancer immunotherapy[J].Biology,2021,10(325):1-12.
[5]Martin L,Senesse P,Gioulbasanis I,et al.Diagnostic criteria for the classification of cancer-associated weight loss[J].J Clin Oncol,2015,33(1):90-99.
[6]Soeters P B,Wolfe R R,Shenkin A.Hypoalbuminemia:pathogenesis and clinical significance[J].Journal of Parenteral and Enteral Nutrition,2019,43(2):181-193.
[7]WU M,PAN Y,JIA Z,et al.Preoperative plasma fibrinogen and serum albumin score Is an independent prognostic factor for resectable stage II-III gastric cancer[J].Dis Markers,2019,2019:9060845.