和田县农村居民膳食模式与炎症因子相关性研究
作者: 姑丽切克然·艾斯克 开比努尔·再比布力 迪娜·木合亚提 吕梅霞 韩加
摘 要:目的:分析和田县维吾尔族农村居民膳食模式与炎症因子的相关性,为合理指导人群健康服务。方法:2018年8月在新疆和田县开展的膳食营养状况调查,采用食物频率问卷结合24小时膳食回顾法收集调查者膳食摄入情况,并通过因子分析法建立膳食模式,采用多元线性回归分析不同膳食模式与炎症因子相关性。结果:通过因子分析方法得出4种膳食模式,即水果奶类模式、主食蔬菜模式、高盐高脂模式及肉类模式。多元线性回归分析结果显示,瘦素(LEP)与水果奶类模式(β=-0.21,95%CI=-0.10~ -0.02)和主食蔬菜模式(β=-0.31,95%CI=-0.13~ -0.05)呈负相关;脂联素(ADP)与主食蔬菜模式(β= -0.26,95%CI= -0.18~ -0.06)和高盐高脂模式(β= -0.30,95%CI= -0.20~ -0.08)呈负相关。结论:和田县维吾尔族农村居民膳食模式调查中,水果奶类模式和主食蔬菜模式与低炎症水平有关,而高盐高脂模式与较高炎症水平有关。
关键词:膳食调查;炎症因子;因子分析
炎症是人体对有害刺激的免疫防御机制,持续的炎症刺激导致慢性低度炎症[1]。2003年Hotamisligil等[2]首次提出,肥胖是由不同炎症因子诱导产生的一种全身性慢性低度炎症状态。膳食模式可以评估食物营养素与健康间的复杂相互作用,并可能与炎症状态有关[3]。Hart等[4]认为,膳食是全身性慢性炎症的重要影响因素,坚持健康饮食或地中海饮食模式,可降低炎症水平。为了克服单一营养素或食物的局限性,膳食模式分析被提出,从宏观角度整体分析膳食摄入与健康或疾病之间的关系[5]。随着农村经济的全面发展和农民收入的不断提高,居民日常膳食结构也发生了较大变化,肥胖相关慢性病也在逐年增加。本研究分析农村居民膳食模式与炎症因子的相关性,为从人群健康角度进行饮食干预提供科学依据。
1 研究对象与方法
1.1 研究对象
资料来源于2018年8月在新疆和田县开展的膳食营养状况调查。本研究根据纳入排除标准共纳入研究对象336名。纳入标准:年龄25~65岁;在调查地区长期居住(>5年)的居民;排除标准:患有严重疾病,如肝、肾、心血管疾病及肿瘤等;孕妇、哺乳期妇女等。本研究获新疆医科大学第一附属医院伦理委员会批准[20170214-150],所有研究对象均签署知情同意书。
1.2 研究方法
1.2.1 一般情况调查 调查研究对象一般人口学特征(包括性别、年龄、月收入、学历、婚姻状况、吸烟、饮酒等信息)以及人体测量(身高、体重)。计算体重指数(BMI)=体重/身高2(kg/m2)。
1.2.2 膳食模式分析 (1)膳食调查:采用食物频率问卷(FFQ)结合24小时膳食回顾法(包括研究对象24小时内早餐、午餐、晚餐及其他摄入的各类食物及其数量)获得研究对象每日各类食物摄入量。在调查过程中,使用各种食物图谱、食具作为参考。根据《中国食物成分表》,计算研究对象人均各类食物所含能量和各种营养素摄入量。(2)膳食模式分析方法:采用因子分析对膳食数据进行分析并经过极大方差旋转后,抽取4种主要因子,按因子载荷大小排序,根据因子载荷数值的大小及其食物组特点划分并命名。
1.2.3 生化指标检测 由调查员采集研究对象清晨空腹(禁食12h)静脉血2~3 mL,采用酶联免疫吸附法检测瘦素(LEP)、肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)、脂联素(ADP)、C-反应蛋白(CRP)和抵抗素(RETN),试剂盒由Elabscience公司生产。
1.3 统计学方法
数据录入Excel建立数据库,应用营养计算软件V2.7.5.8计算每日各类食物、能量及各类营养素摄入量。计量资料符合正态分布的以均数±标准差表示,组间比较采用t检验;偏态分布以M(P25,P75)表示,组间比较采用秩和检验。采用因子分析方法建立膳食模式,采用线性回归分析膳食模式和炎症因子的关系。所有数据均用SPSS 26.0 统计软件进行分析。以P<0.05为差异有统计学意义。
2 结果与分析
2.1 一般情况
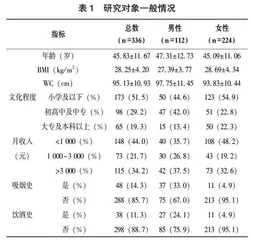
共纳入研究对象 336 名,平均年龄(45.83±11.67)岁,男性112人(33.3%)、女性224人(66.6%)(表1)。
2.2 膳食模式分析
对研究对象的膳食数据进行因子分析,根据各膳食模式主要食物特点结合特征值、碎石图和累计贡献率的结果得出4种膳食模式,分别为水果奶类模式、主食蔬菜模式、高盐高脂模式、肉类模式。因子分析结果:KMO=0.563>0.5、Bartlett 球形检验χ2=189.802、P<0.001(表2)。
2.3 不同膳食模式与炎症因子比较
将各类膳食模式因子得分按照由低到高四等份划分,分别命名为 Q1、Q2、Q3、Q4组。表3结果显示,IL-6在水果奶类模式和高盐高脂模式不同得分组间存在差异;TNF、RETN在水果奶类模式、高盐高脂模式和主食蔬菜模式不同得分组间均存在差异;CRP在水果奶类模式得分组间存在差异;LEP与水果奶类模式和肉类模式得分组存在差异;ADP与4种膳食模式得分组均存在差异(P<0.05)。
2.4 不同膳食模式与炎症因子的关系
从表2~4可知,以炎症相关因子作为因变量,膳食模式得分作为自变量进行线性回归分析。结果显示,LEP在水果奶类模式与主食蔬菜模式呈负相关,存在统计学差异(P<0.05);ADP在主食蔬菜模式与高盐高脂模式呈负相关,存在统计学差异(P<0.05)。其余无统计学差异(P>0.05)。
3 讨论
某些营养素的缺乏或过量会使免疫系统功能障碍,进而导致炎症状态失衡[7]。健康饮食通常与较低的炎症水平有关。Norde等[8]对12项观察性研究进行系统回顾和荟萃分析,结果表明,健康饮食具有降低炎症生物标志物的潜力,并可能有效地预防慢性疾病。然而,由于膳食摄入的复杂性,膳食因素对炎症水平的影响尚没有明确的定论[7]。本研究分析了农村居民膳食营养状况,并通过因子分析方法得到4种膳食模式,即水果奶类模式、主食蔬菜模式、高盐高脂模式及肉类模式。在膳食模式和炎症因子的多元线性回归分析中,水果奶类模式与LEP呈负相关,表明奶类水果模式是LEP的保护因素,有助于调节炎症水平。Ibars等[9]报道,食用富含多酚类的水果可通过调节下丘脑瘦素信号通路来增加瘦素敏感性。虽然没有足够的证据证明奶制品为“抗炎食品”,但奶类中的生物活性蛋白和脂质可以发挥抗炎作用[10]。本研究中主食蔬菜模式也与LEP呈负相关,提示随着蔬菜谷粮类摄入增多,促炎因子LEP水平降低。主食蔬菜模式因含有膳食纤维可能是LEP的保护因素。
随机对照试验证据表明,采用植物性饮食(包括但不限于地中海饮食)对炎症生物标志物有重大影响,即增加全谷物、水果和蔬菜的摄入量可以降低炎症水平,其抗炎作用可能与全谷物、水果和蔬菜富含的维生素、膳食纤维和植物化学物有关[11]。ADP是一种抗炎脂肪细胞因子,在调节脂质代谢和抑制炎症过程中起重要作用[12]。本研究中主食蔬菜模式与ADP负相关。该模式中除了主食、蔬菜类外,油脂类、坚果类摄入量也较高。此外,调查居民高盐高脂模式与ADP呈负相关。有研究表明[13-14],饮食中油盐摄入量与炎症水平有关,本研究结果与之一致,即油盐摄入量增多,抗炎因子ADP水平降低。这与当地居民长期摄入牛、羊肉等饱和脂肪酸、胆固醇含量较高的膳食结构可能有关。膳食总脂肪和胆固醇高消耗与ADP浓度负相关[15]。Prates等[16]也报道,摄入大量的饱和脂肪酸与ADP浓度呈负相关。其他炎症因子在本研究中与膳食模式未见统计学差异还有待进一步分析。
综上所述,通过饮食调节炎症水平可能是降低非传染性疾病风险的一个关键策略。本调查人群水果奶类模式和主食蔬菜模式与低炎症水平有关,而高盐高脂模式与较高炎症水平有关。因此制定有效的饮食干预措施和公共卫生政策,增加居民全谷物、蔬菜水果、豆奶摄入,减少油脂和盐类摄入,对改善当地人群炎症水平,促进健康具重要意义。
参考文献
[1]Karin M,Clevers H.Reparative inflammation takes charge of tissue regeneration[J].Nature,2016,529(7586):307-315.
[2]Hotamisligil SG.Inflammatory pathways and insulin action[J].Int J Obes Relat Metab Disord,2003,27:53-55.
[3]Djoussé L,Padilla H,Nelson TL,et al.Diet and metabolic syndrome[J].Endocr Metab Immune Disord Drug Targets,2010,10(2):124-137.
[4]Hart MJ,Torres SJ,McNaughton SA,et al.Dietary patterns and associations with biomarkers of inflammation in adults:a systematic review of observational studies[J].Nutr J,2021,20(1):24.
[5]Craddock JC,Neale EP,Peoples GE,et al.Vegetarian-based dietary patterns and their relation with inflammatory and immune biomarkers:A systematic review and meta-analysis[J].Adv Nutr,2019,3:433-451.
[6]Aleksandrova K,Koelman L,Rodrigues CE.Dietary patterns and biomarkers of oxidative stress and inflammation:A systematic review of observational and intervention studies[J].Redox Biol,2021,42:101869.
[7]Gill PA,Inniss S,Kumagai T,et al.The role of diet and gut microbiota in regulating gastrointestinal and inflammatory disease[J].Front Immunol,2022,5(13):866059.
[8]Norde MM,Collese T.S,Giovannucci E,et al.A posteriori dietary patterns and their association with systemic low-grade inflammation in adults:A systematic review and meta-analysis[J].Nutr Rev,2021,79:331-350.
[9]Ibars M,Aragonès G,Ardid-Ruiz A,et al.Seasonal consumption of polyphenol-rich fruits affects the hypothalamic leptin signaling system in a photoperiod-dependent mode[J].Sci Rep,2018,8(1):13572.
[10]Hess JM,Stephensen CB,Kratz M,et al.Exploring the links between diet and inflammation:Dairy foods as case studies[J].Adv Nutr,2021,12(1):1S-13S.
[11]Grosso G,Laudisio D,Frias-Toral E,et al.Anti-inflammatory nutrients and obesity-associated Metabolic-inflammation:State of the art and future direction.[J].Nutrients,1970,14(6):1137.