液相色谱高分辨串联质谱法测定奶粉中A2 β 酪蛋白及β酪蛋白与乳清蛋白含量关系的研究
作者: 刘彤彤 房芳 罗娇依 曹进 孙姗姗
摘要:目的:建立奶粉中A2 β酪蛋白分离定量的液相色谱高分辨串联质谱法,并利用婴儿配方奶粉中酪蛋白、乳清蛋白和总蛋白含量的关系,间接得到乳清蛋白含量。方法:样品经前处理后,采用ACQUITY UPLC HSS T3柱(100 mm×2.1 mm×1.8 μm),0.1%甲酸水和乙腈为流动相,梯度洗脱分离。多反应离子监测模式定量测定其中的A2 β酪蛋白特征肽。结果:在0.02~2.0 μmol/L范围内线性关系良好(r=0.993 8)。在低、中、高三水平加标试验中,回收率在94.9%~98.7%,相对标准偏差在1.7%~3.7%,检出限为0.80 mg/100 g,可满足对奶粉中A2 β酪蛋白定量要求。采用该法对市售11批声称A2奶粉和18批未声称A2奶粉(以下简称A2奶粉和普通奶粉)中A2 β酪蛋白进行测定。结论:A2奶粉中A2 β酪蛋白占总β酪蛋白含量的86.2%~98.7%,而普通奶粉则低至20.0%~50.0%。另外,乳清蛋白含量的间接测定值和理论计算值经统计分析,无明显差异(P>0.05),为分析婴儿配方奶粉中乳清蛋白含量是否符合国标要求提供参考。
关键词:A2 β酪蛋白;液相色谱高分辨串联质谱;乳清蛋白;奶粉有研究认为,只含有A2 β酪蛋白的牛奶可以预防或缓解因食用普通牛奶而产生的胃肠道不适症状[19]。婴儿配方奶粉为模拟成熟母乳中蛋白配比(乳清蛋白:酪蛋白=6∶4),通过添加浓缩乳清蛋白粉、脱盐乳清粉强化乳清蛋白的含量。国标(GB10765—2010)[10]中对婴儿配方奶粉中的乳清蛋白含量做出了明确规定(≥60%),但乳清蛋白的检测方法目前没有国标,现有的检测方法存在一定缺点和局限性[1112]。乳粉生产企业往往是根据乳粉中各原料所含乳清蛋白含量,获得乳粉中乳清蛋白含量的计算值,难以获得乳清蛋白含量的测定值。本试验利用液相色谱高分辨串联质谱,对市场上A2奶粉和普通奶粉进行检测分析,建立起奶粉中A2 β酪蛋白分离及定量的方法,为A2奶粉的鉴别提供有效的技术手段。另外,本研究尝试利用婴儿配方奶粉中酪蛋白、乳清蛋白和总蛋白含量的关系,在测定其中酪蛋白含量的基础上,间接得到乳清蛋白含量,即乳清蛋白=总蛋白含量总酪蛋白含量,以此实现对乳清蛋白的定量。
1材料与方法
1.1试剂与材料
β酪蛋白特征肽段VLPVPQK标准品(纯度≥98.57%,分子量=780.0 g/mol)、β酪蛋白特征肽段内标SQSKVL*(13C6,15N)PVPQKAVPY(纯度≥98.84%,分子量=1 648.0 g/mol)、A2 β酪蛋白特征肽标准品IHPFAQTQSLVYPFPGPIPNSLPQNIPPLTQTPVVVPPFLQPEVMG
VSK(纯度≥98%,分子量=5 315.8 g/mol)、A1 β酪蛋白特征肽标准品IHPFAQTQSLVYPFPGPIHNSLPQNIPPLTQTPVVVPPFLQPEVMGVSK(纯度≥98%,分子量=5 355.8 g/mol),上海吉尔生化有限公司提供;胰蛋白酶(质谱级),美国赛默飞世尔科技公司;甲酸、乙腈(质谱级),美国赛默飞世尔科技公司;三羟甲基氨基甲烷(分析纯,美国 Sigma Aldrich公司);Triton X100(分析纯),美国 Sigma Aldrich公司;硫酸(分析纯),国药集团化学试剂有限公司;Foss催化剂片,丹麦福斯集团公司;试验用水为MilliQ超纯水。
奶粉样品共30批,包括普通奶粉18批(均为婴配)、A2奶粉11批(A2婴配奶粉5批、A2调制乳粉6批)、豆基奶粉1批,采购于京东网络平台。
1.2仪器与设备
Waters UPLCVevo TQS液相色谱串联三重四级杆质谱仪、Masslynx质谱软件,美国沃特世科技有限公司;B491恒温水浴锅,瑞士BUCHI公司;XP 205分析天平,瑞士梅特勒托利多公司;SI VortexGenie 2涡旋振荡器,美国Scientific Industries公司;贺力氏Pico21离心机,美国赛默飞世尔科技有限公司;凯氏定氮仪Kjeltec 8200,丹麦福斯集团公司。
1.3方法
1.3.1试样前处理参照孙姗姗等[13]的方法并做适当调整,称取试样1 g(精确至0.001 g)于50 mL容量瓶中,加入30 mL TrisHCl(50 mmol/L)溶液,充分溶解后定容。60 ℃水浴1 h,冷却混匀后取上述样液20 mL,加入10 mL NaCl溶液(0.5 mol/L,含0.2%Triton X100)混匀,用3%甲酸溶液调节pH至4.6~4.8,室温过夜,离心(10 000 r/min、15 ℃、15 min)后弃去上清。用10 mL TrisHCl(50 mmol/L)溶液复溶沉淀,准确移取100 μL上述样液,加入40 μL β酪蛋白特征肽段内标(2.5 μmol/L),10 μL胰蛋白酶液(1 mg/mL),加水定容至1 mL,涡旋混匀后置于37 ℃水浴中恒温15~16 h,取出加入10 μL 10%的甲酸溶液终止反应,混匀后离心(10 000 r/min、4 ℃、10 min),取上清供检测用。
1.3.2总蛋白质含量测定参考GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》[14]第一法 凯氏定氮法操作。称取样品0.2 g,精确至0.001 g,至消化管中,再加入1片Foss催化剂片(0.4 g CuSO4·5H2O和3.5 g K2SO4)及20 mL硫酸于消化炉进行消化。当消化炉温度达到420 ℃后,继续消化1 h,此时消化管中的液体呈绿色透明状,取出冷却后于自动凯氏定氮仪上实现自动加液、蒸馏、滴定和记录滴定数据的过程。
1.3.3标准曲线的配制精确称取适量标准品,用TrisHCl(50 mmol/L)溶液溶解,得到标准储备液:β酪蛋白特征肽段和A2 β酪蛋白特征肽标准品浓度均为400 μmol/L,β酪蛋白特征肽段内标浓度为10 μmol/L;分别取标准储备液适量,用TrisHCl(50 mmol/L)溶液稀释,得到标准中间液:β酪蛋白特征肽段和A2 β酪蛋白特征肽标准品浓度均为4 μmol/L,β酪蛋白特征肽段内标标准中间液浓度为2.5 μmol/L;取β酪蛋白特征肽段和A2 β酪蛋白特征肽标准中间液适量,加入内标标准中间液40 μL、胰蛋白酶液(1 mg/mL)10 μL,用水定容至1 mL混匀,配置成浓度分别为0.02、0.1、0.2、1.0、2.0 μmol/L的标准工作液,后续酶解操作和1.3.1样品酶解同时进行,取上清进样并绘制标准曲线。
1.3.4色谱条件色谱柱:ACQUITY UPLC HSS T3柱(100 mm×2.1 mm× 1.8 μm);柱温30 ℃;进样量5 μL;流速0.3 mL/min。流动相A:0.1%甲酸水溶液。流动相B:乙腈。线性梯度洗脱程序:0~0.5 min,95%A;0.5~4.5 min,95%~50%A;4.5~4.6 min,50%~35%A;4.6~6.6 min,35%A;6.6~6.7 min,35%~95%A;6.7~9.0 min,95%A。
1.3.5质谱条件电喷雾离子源正离子模式;毛细管电压3 500 V,脱溶剂气温度500 ℃,脱溶剂气流速800 L/h。多离子反应监测模式,A2 β酪蛋白特征肽检测离子对m/z 1 330.596→1 297.67和m/z 1 330.596→715.263,碰撞能量为19 V和25 V;A1 β酪蛋白特征肽检测离子对m/z 1 340.59→1 311和m/z 1 340.59→715.2,碰撞能量为27 V和31 V;β酪蛋白特征肽检测离子对m/z 391→568和m/z 391→213,碰撞能量为11 V和9 V;β酪蛋白(内标)特征肽检测离子对m/z 394.5→568和m/z 391→285,碰撞能量为11 V和12 V。
2结果与分析
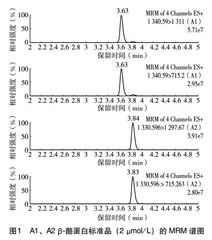
2.1A1、A2 β酪蛋白标准品和典型的A2、普通奶粉样品的谱图分析由图1可知,A1 β酪蛋白标准品在3.63 min出峰、A2 β酪蛋白标准品在3.84 min出峰,对照图2的A2、普通奶粉在对应位置的出峰,说明在1.3的前处理及色谱质谱条件下,A1和A2 β酪蛋白在样品中分离情况良好,峰形也符合定量要求。同时可看出,2种奶粉中A1和A2 β酪蛋白的分布及含量区别。选取的2种奶粉样品中,普通奶粉中两种β酪蛋白均有检出,A2奶粉也检出少量A1 β酪蛋白。
2.2方法学验证结果
2.2.1线性范围、检出限和定量限在0.02~2.0 μmol/L范围内,r=0.993 8,表明此范围内建立的标准曲线线性关系良好,可用于定量分析。将前处理得到的样品溶液稀释进样,以信噪比3∶1时的浓度为检出限,10∶1时的浓度为定量限,得到检出限和定量限分别为0.80、2.7 mg/100 g。
2.2.2回收率和精密度取不含A2 β酪蛋白的豆基奶粉作为空白基质,通过3个加标水平来评估回收率,分别为100、500、1 500 mg/100 g,每个加标水平做6次平行,回收率在94.9%~98.7%,各加标水平的精密度为1.7%~3.7%,表明在该方法条件下,回收率和精密度均良好。
2.3A2奶粉和普通奶粉中A2 β酪蛋白的测定
由表2~3和图3~4可见,A2奶粉样品中A2 β酪蛋白测定结果在1.05~1.83 g/100 g,β酪蛋白在1.07~2.17 g/100 g,A2 β酪蛋白含量占比范围为86.2~98.7%,约是A1 β酪蛋白含量的6~75倍。普通奶粉中A2 β酪蛋白测定结果在0.31~1.15 g/100 g,β酪蛋白在1.44~2.31 g/100 g,A2 β酪蛋白含量占比多集中在20.0%~50.0%,A1 β酪蛋白含量约是A2 β酪蛋白的1~4倍,另外,有2份样品的A2 β酪蛋白含量分别为70.0%、75.0%。
A2奶粉和普通奶粉中A2 β酪蛋白含量差异明显,本试验的普通奶粉中A2 β酪蛋白含量范围(20.0%~50.0%)与Buchberger[15]的测定结果大体一致(29%~54%),但比Cardak[16](67%)、冯慿[17](58.1%~68.8%)和Givens[1](A2 β酪蛋白含量56.1%~62.1%)的研究结果低,这可能与奶粉的奶源不同有关,不同地区奶牛的基因型不同,生产的牛奶中A1和A2 β酪蛋白的比例也有不同程度的差异[1819],2批普通奶粉中A2 β酪蛋白占比超过70%或许也是因为此原因。本试验的A2奶粉样品中检测出少量的A1 β酪蛋白,冯慿[17]和刘泽阳[20]的研究中也有相似的结果。一方面可能与A2奶源筛选的方法灵敏度有关[20],另一方面,部分乳粉生产企业宣称在前期进行奶牛和奶源筛选,但缺乏对奶粉成品的A2 β酪蛋白检测,在生产过程中可能会引入少量A1 β酪蛋白,造成在成品奶粉中检出。另外,目前国内外缺乏A2奶粉中A2 β酪蛋白含量占比的限量标准,难以对其进行评判。根据本试验的测定结果建议,A2奶粉中A2 β酪蛋白含量占比在85%以上可能是比较合理的。
2.4在婴儿配方奶粉的乳清蛋白含量中的应用
表4中根据β酪蛋白在总酪蛋白中含量占比(取值36%)[12]和试验测得的β酪蛋白含量,可得到总酪蛋白计算值,结合奶粉的总蛋白质测定值,即乳清蛋白=总蛋白含量总酪蛋白含量,进而得出乳清蛋白含量间接测定值。根据乳粉生产企业的原料中乳清蛋白占比数据,计算得到乳清蛋白含量理论计算值。将5批A2婴儿配方奶粉(表4中样品1~4号)和5批普通婴儿配方奶粉(表4中样品的5~10)的乳清蛋白含量间接测定值与理论计算值进行比较,乳清蛋白含量间接测定值范围在60.3%~65.3%,乳清蛋白含量理论计算值在60.8%~65.8%,通过t检验发现P值>0.05,两种类型婴儿配方奶粉乳清蛋白含量间接测定值和理论计算值之间差异均不显著,且符合国标要求(≥60%)。
3结论
本试验利用液相色谱高分辨串联质谱,建立起奶粉中A2 β酪蛋白分离及定量的方法,方法回收率、精密度良好。利用本方法对市场上A2奶粉和普通奶粉进行检测分析,结合β酪蛋白含量,考察了其中A2 β酪蛋白含量的情况,本方法可作为识别区分A2和普通奶粉的有效手段。并为未来制定A2奶粉的限值规定提供了充分的数据支持。同时,利用婴儿配方奶粉中乳清蛋白和酪蛋白的关系,在测定其中酪蛋白含量的基础上,间接得到乳清蛋白含量,为分析婴儿配方奶粉中乳清蛋白含量是否符合国标要求提供了参考。