通过FDA警告信浅谈国内外益生菌产品管理现状
作者: 彭露慧 刘奕雯 张梓灵
人体肠道菌群对健康起着至关重要的作用,肠道菌群紊乱和多种严重疾病相关。益生菌具有调节菌群平衡的作用,在美国常见于膳食补充剂中。近年来,益生菌在促进肠道健康方面的应用空前增长,开始作为生物治疗来缓解与发育不良相关的某些临床疾病。对于免疫系统健全的人,益生菌总体安全。但是,对于免疫力低下人群,益生菌的不当使用可能带来严重感染的风险,且目前的数据支持,应对医院内的早产儿绝对禁用。
目前FDA还未批准任何益生菌产品作为药物或生物制品用于婴儿相关产品生产,然而有些产品未经批准就进行销售,认为有利于预防早产儿患坏死性小肠结肠炎的风险。2023年10月24日,FDA向雅培实验室发出警告信,称其益生菌产品含有两种对婴儿可能不安全的成分。该警告信主要指出了其生产的益生菌产品存在菌种鉴定不清晰、产品标签误导消费者等问题。随后FDA要求雅培对这些问题进行整改,以确保产品的安全性和有效性。FDA表示,那些服用益生菌产品的婴儿有患上侵袭性、潜在致命疾病或感染的风险,而这些疾病或感染是由益生菌中的细菌或酵母菌引起的。
一、背景及概述
根据世界卫生组织的定义,益生菌是指当摄取足够数量时,对宿主发挥有益作用的活的微生物。通过调节肠道内菌群平衡,或调节宿主黏膜与系统免疫功能,可以促进营养吸收,维持肠道健康,进而产生对身体健康发挥积极作用的单微生物或组成明确的混合微生物。但是,益生菌具有菌株特异性,品类繁多,在某些患者群体中应谨慎使用,尤其是早产儿或免疫缺陷的新生儿。婴幼儿的免疫系统和消化系统的发育尚不完善,一些益生菌可能利用这一优势,进一步恶化病情,变成机会致病的病原体,引发危及生命的肺炎、心内膜炎和脓毒症。
目前FDA已收到早产儿因服用益生菌,细菌扩散全身导致死亡的病例,同时,近五年来有数十例类似的病历还在调查。FDA尚未批准任何益生菌产品作为药物或生物制品用于婴儿。以此为目的进行销售的产品没有经过FDA的上市前安全性和有效性审查评估,也没有按照该局的药品和生物制品生产和检测标准进行评估,包括外来生物检测。医疗保健提供者如果使用益生菌来治疗、减轻、治愈或预防疾病或病症,必须向FDA提交新药研究申请。
二、警告信内容
2023年10月24日,婴幼儿配方奶粉制造商雅培实验室收到了一封来自FDA的警告信,涉及其益生菌产品Similac益生菌三重混合物,其中含有婴儿双歧杆菌(Bb-02)、嗜热链球菌(TH-4)和乳双歧杆菌(BB-12)。信中表示,在审查雅培实验室的官网信息和产品信息后,认定该公司对其益生菌产品的介绍宣传信息表明其旨在用于缓解、治疗或预防疾病。然而由于该益生菌产品并未通过药品监管审批,属于未经批准的新药和未经许可的生物制品,因此违反了《联邦食品、药物和化妆品法》(FD&C法案)[21U.S.C.§331(d)]和《公共卫生服务法案》(PHS法案)[42U.S.C.§262(a)(1)]的规定。此外,警告信还指出,根据FD&C法案402(a)(2)(C)(i)和(f)(1)(B)部分的[21U.S.C.§342(a)(2)(C)(i)和(f)(1)(B)]条例,认定该益生菌产品为掺假食品(Adulterated Food)。FDA表示,根据FD&C法案201(s)和409(a)部分的[21U.S.C.§321(s)和348]条例,Bb-02是一种不安全的食品添加剂,TH-4是一种新的、未经证实的膳食成分,没有足够的信息合理保证这种成分在用于早产儿时不会带来重大或不合理的疾病或伤害风险。在收到FDA的警告后,雅培实验室迅速做出反应,对生产过程中存在的问题进行自查,并撤回了其中相关的益生菌产品。
三、总结与分析
在美国,FDA负责益生菌的监督管理。益生菌可以通过“公认安全使用物质”(GRAS)、食品添加剂新品种和“新的膳食成分”(NDI)三种方式被引入市场。从FDA警告信可以看出,警告信中涉及的具有功能性宣称的益生菌产品既不是经过审批的新药或生物制品,也不属于上述的三种情况。
由于国内“益生菌”尚无统一的定义及国家标准,相关产品可按普通食品或保健食品分类许可、注册备案及监管,故笔者暂且称之为“普通食品及保健食品加工用菌种及其制剂”(制剂为保健食品的说法,普通食品不含制剂)。
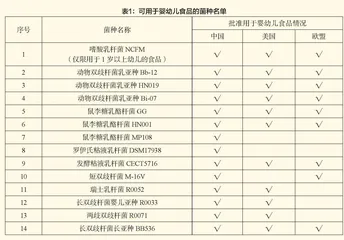
目前该类相关产品一般以《可用于食品的菌种名单》《可用于婴幼儿食品的菌种名单》及《可用于保健食品的益生菌菌种名单》作为生产的添加使用依据。不在名单中且在中国没有传统安全食用历史的微生物菌种,按照新食品原料管理,需申报获得批准,增补到菌种名单中才可用于生产。截至目前,我国共有14株菌株被批准用于婴幼儿食品(见表1)。添加于雅培益生菌产品中的Bb-02与TH-4属于我国未批准用于婴幼儿食品的菌种。
警告信中反映出的菌种鉴定不清晰、标签误导消费者以及其安全性和有效性未经验证等问题,为国内同类产品的管理提供了一定的借鉴价值。结合警告信,笔者初步整理了国内针对上述问题所做的工作及关注方向。
(一)规范合理使用“普通食品及保健食品加工用菌种及其制剂”名称
相关部门应依据现有的《可用于食品的菌种名单》《可用于婴幼儿食品的菌种名单》及《可用于保健食品的益生菌菌种名单》(以下简称《名单》),明确普通食品、保健食品加工用菌种及其制剂的生产许可或注册备案类别,督促企业规范标示菌种及其制剂名称,对照“名单”定期自查产品中的成份是否符合添加要求,避免超范围使用、添加的情况。
(二)规范普通食品加工用菌种的标签标识及保健食品加工用菌种功能声称
按照上文中的《名单》分类明确标签标识及功能声称的要求,普通食品及保健食品应按照相应的标准或规定进行管理。如普通食品加工用菌种应按《食品安全国家标准 预包装食品标签通则》(GB 7718-2011)中规定:不应标注或暗示具有预防、治疗疾病作用的内容。同时,《食品安全国家标准 预包装特殊膳食用食品标签》(GB 13432-2013)中对特殊膳食的标签标识也有明确的规定,除了不能涉及疾病预防、治疗功能之外,还不应对0-6月龄婴儿配方食品中的必需成份进行含量声称和功能声称。保健食品加工用菌种应按照《保健食品原料目录与保健功能目录管理办法》和《允许保健食品声称的保健功能目录 非营养素补充剂(2023年版)》的规定对产品的功能声称予以规范。
(三)健全完善相关标准体系和评价技术指导原则,规范生产要求,提升安全、功效水平
1.制定“普通食品加工用菌种”相关国家标准,明确规定普通食品加工用菌种的定义、范围、安全指标、检测方法及生产规范等。与普通食品加工用菌种相关的国家标准有今年9月刚刚实施的《食品安全国家标准 食品加工用菌种制剂生产卫生规范》(GB 31612-2023)及《食品安全国家标准 食品加工用菌种制剂》(GB 31639-2023)。GB 31639-2023对于食品用加工菌种的范围、定义、安全指标及检验方法等都做出了明确规定。GB 31612-2023列出了准清洁作业区和清洁作业区的空气洁净度及检验方法,提出了防控噬菌体污染的相关措施,针对细菌类菌种制剂及酵母类菌种制剂分别制订了环境微生物及生产过程产品的微生物监控要求。
2.建立健全相关技术文件,规范注册备案要求,提升保健食品加工用菌种质量安全功效水平。为进一步规范益生菌类保健食品注册的有关要求,提升益生菌类保健食品的质量安全功效水平,经与国家卫生健康委协商一致,市场监管总局制定了《保健食品及其原料安全性毒理学检验与评价技术指导原则(2020年版)》《保健食品原料用菌种安全性检验与评价技术指导原则(2020年版)》《保健食品理化及卫生指标检验与评价技术指导原则(2020年版)》等技术文件。组织修订益生菌类保健食品注册审评技术法规,由“菌种”水平细化到“菌株”水平,提高保质期内活菌数目。安全性评估方面,《保健食品原料用菌种安全性检验与评价技术指导原则(2020年版)》规定了保健食品原料用细菌、丝状真菌(子实体除外)和酵母的安全性评价中的致病性(毒力)检验与评价程序和方法,适用于保健食品原料用菌种(包括保健食品配方用及原料生产用菌种)的致病性检验与评价。
“益生菌”类产品(普通食品及保健食品加工用菌种及其制剂)在国内的管理也应将警告信中的问题引以为戒,重视规范合理使用菌种名称、规范标签标识或功能声称、提升安全性及有效性、落实企业主体责任,促进新质生产力高质量发展。
注:彭露慧、刘奕雯均为第一作者。