2022—2024年食品微生物能力验证的结果分析探讨
作者: 邵悦 刘永泽 卢福荣 李杰
摘 要:能力验证是保障实验室质量控制的有效方法,定期参加能力验证能够提高检验员的技术操作能力和分析水平,为实验室建设提供保障。依据能力验证指导书和食品微生物学检验的相关要求对能力验证的样品进行检测。经评价,3次能力验证,6个考核结果|Z|值均小于2.0,结果为满意,证明本实验室具备食品中金黄色葡萄球菌、霉菌和酵母、菌落总数的检测能力。
关键词:能力验证;金黄色葡萄球菌;霉菌和酵母;菌落总数
Analysis and Discussion on the Results of Food Microbial Capability Validation from 2022 to 2024
SHAO Yue, LIU Yongze, LU Furong, LI Jie
(Yingkou Food and Drug Testing Center, Yingkou 115000, China)
Abstract: Capability verification is an effective method to ensure laboratory quality control. Regular participation in capability verification can improve the technical operation ability and analytical level of inspectors, and also provide guarantees for laboratory construction. According to the guidelines for proficiency testing and the relevant requirements of food microbiological testing, the samples for proficiency testing shall be tested. After evaluation, 3 proficiency tests were conducted, and 6 assessment results showed |Z| values less than 2.0, indicating satisfaction. This proves that our laboratory has the ability to detect Staphylococcus aureus, mold, yeast, and total bacterial count in food.
Keywords: capability verification; Staphylococcus aureus; mold and yeast; total number of bacterial colonies
金黄色葡萄球菌在自然界中分布广泛,可导致人的多种疾病,严重危害人体健康。霉菌和酵母均属于真菌,具有很强的代谢能力。相关研究表明,如果长期食用霉菌和酵母超标的食品,会诱发癌症。菌落总数指细菌总量,包含多种样态的细菌,可用于评估食品样品中微生物污染的严重程度及其卫生质量。人体长期食用菌落总数超标的食物,可能会引起胃肠道疾病[1]。因此,常选择金黄色葡萄球菌、霉菌和酵母、菌落总数作为食品质量安全指标。为此,微生物实验室定期参加能力验证至关重要,这对于人员能力评价、方法验证、数据或结果准确性评价等方面均具有非常重要的意义[2]。本文对2022—2024微生物实验室连续3年的能力验证进行论述,以为实验室质量控制提供参考。
1 材料与方法
1.1 样品来源
本次实验收到了6份待测样品,其中,2022年
中国检验检疫科学院测试评价中心发放ACAS-PT1339(2022)食品中金黄色葡萄球菌能力验证样品2份,编号为22-C540和22-Q626;2023年中国检验检疫科学院测试评价中心发放ACAS-PT1588(2023)霉菌和酵母计数能力验证样品2份,编号为23-T787和23-T269;2024年华测检测认证集团股份有限公司发放能力验证样品2份,编号为LNSCJG-24-02 268和LNSCJG-24-02 331。
1.2 材料和试剂
Baird-Parker琼脂平板、冻干血浆、血平板、BHI肉汤、孟加拉红(亦称虎红)琼脂、平板计数琼脂培养基(Plate Count Agar,PCA),所有试剂均购自广东环凯微生物科技有限公司;氯化钠(分析纯),批号为20220927,国药集团化学试剂有限公司;无菌水,实验室自制,由纯水机(UPH-IV-207)制备。
1.3 仪器和设备
生化培养箱(BSP-250型与BSP-400型),上海博迅实业有限公司医疗设备厂;霉菌培养箱(DMJ-250C)、立式压力灭菌器(YXQ-75G),上海博迅医疗生物仪器股份有限公司;恒温水浴锅(HH-ZK6),巩义市予华仪器有限责任公司;生物安全柜(HR1500-IIA2),青岛海尔生物医疗股份有限公司。
1.4 实验方法
1.4.1 样品前处理
依据参试指导书,对样品进行预处理。开启样品封装后,迅速向西林瓶内注入适量稀释液,待样品完全融解,通过移液器将溶液吸取并转移至无菌容器内,用剩余稀释液多次冲洗西林瓶内壁,回收冲洗液并转移至无菌容器中,所得溶液即为待测样品的初始溶液,也被称为原液。各环节操作均在生物安全柜中进行,以确保样品结果的准确性和人员的安全性。
1.4.2 样品稀释
在无菌条件下,使用移液器精确量取25 mL的原液样品(100),注入225 mL的无菌稀释液,进行稀释,再通过均质化处理,使其充分混合均匀,获得1∶10的样品均质液(10-1)。从均质液中吸取1 mL,加入装有9 mL无菌稀释液的试管内,并用旋涡混合器充分混匀,获得1∶100的样品均质液(10-2)。通过上述操作,可以逐步制备出浓度递减的系列样品均质液(共制备5个梯度稀释液,分别为10-1、10-2、10-3、10-4、10-5)。
1.4.3 金黄色葡萄球菌检测
完成样品稀释后,从5个梯度稀释液中(不包括原液)分别取0.3、0.3、0.4 mL涂布3块BP(Baird-Parker)平板,将其倒置于(36±1)℃条件下培养48 h,并记录好每个平板的菌落数。选择典型菌落,分别进行革兰氏染色镜检和血浆凝固酶试验。同时,将典型菌落划线接种到血平板上,并将其放置在(36±1)℃的条件下培养24 h。按照《食品安全国家标准 食品微生物学检验 金黄色葡萄球菌》(GB 4789.10—2016)第二法中的要求进行培养计数。
1.4.4 霉菌和酵母检测
完成样品稀释后,将样品原液和5个稀释梯度的样品匀液作两个平行样,分别吸取1 mL放置于平皿中,再将20~25 mL孟加拉红培养基(冷却至46 ℃)倾注平皿,并轻轻转动使其混合均匀。参照《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》(GB 4789.15—2016)第一法中的要求进行操作。待孟加拉红琼脂完全凝固后,将培养皿正置于(28±1)℃的霉菌培养箱内进行培养。在培养期间,定时观察,并详细记录实验结果。
1.4.5 菌落总数检测
完成样品稀释后,将样品原液和5个稀释梯度的样品匀液作两个平行样,分别吸取1 mL放置于平皿中,再将已冷却至46 ℃的PCA培养基(约18~20 mL)倾注平皿并轻轻转动,以确保培养基和样品匀液能够均匀铺展于平皿内。待培养基凝固,将培养皿倒置放入(36±1)℃的生化培养箱中培养48 h。全过程控制在15 min以内,以保证样品结果的准确性。按照《食品安全国家标准 食品微生物学检验 菌落总数测定》(GB 4789.2—2022)中的要求进行培养与计数。
2 结果与分析
2.1 结果观察与计数
2.1.1 金黄色葡萄球菌
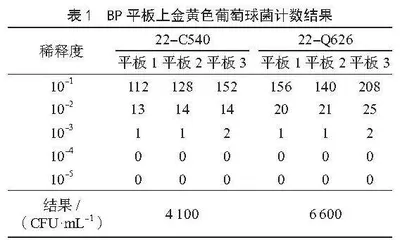
样品22-C540和样品22-Q626的金黄色葡萄球菌在BP平板上的计数情况如表1所示。
从具有代表性的菌落中至少选取5个疑似菌落进行鉴定,经试验后确认为金黄色葡萄球菌,开始计数。针对同一稀释度下的3组平板,若其菌落总数之和在20~200 CFU,则进行计数。按照《食品安全国家标准 食品微生物学检验 金黄色葡萄球菌》(GB 4789.10—2016)中的要求进行计数。由表1可知,两个样品都取10-2梯度进行计数,结果分别为4.1×103 CFU·mL-1和6.6×103 CFU·mL-1。
2.1.2 霉菌与酵母
样品23-C787与23-T269霉菌与酵母的计数情况如表2所示。
选取同一稀释度菌落数在10~150 CFU的两个平板进行计数。按照《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》(GB 4789.15—2016)要求进行计数。由表2可知,编号为23-T787的样品,选用10-2的稀释比例进行霉菌计数,所得结果为2 900 CFU·mL-1。选取原液进行酵母菌计数,所得计数结果为106 CFU·mL-1。编号为23-T269的样品,霉菌的计数选取了10-2的稀释梯度,所得结果为2 600 CFU·mL-1;酵母计数选取原液进行计数,所得结果是81 CFU·mL-1。
2.1.3 菌落总数
样品LNSCJG-24-02 268和样品LNSCJG-24-02 331的菌落总数在PCA平板上的计数情况如表3所示。
菌落总数在计数时取值30~300 CFU,按照《食品安全国家标准 食品微生物学检验 菌落总数测定》(GB 4789.2—2022)中的要求进行计数并修约。样品LNSCJG-24-02 268取10-2梯度进行计数,所得结果为2.0×104 CFU·mL-1。样品LNSCJG-24-02 331取10-2梯度进行计数,所得结果为2.9×104 CFU·mL-1。
在上述3次能力验证实验中,分别完成了培养基空白对照和生理盐水空白对照实验。结果显示,在空白对照实验中均未发现菌落生长,验证了实验的可靠性。
2.2 能力验证结果分析
2022年结果评价22-Q626样品Z值为0.9,22-C540样品Z值为-0.7;2023年结果评价23-C787样品Z值为0.6,23-T269样品Z值为0.5;2024年268样品Z值为0.25。2024年菌落总数能力验证结果通知单显示,两个样品分别为统计样和干扰样,报送结果显示268样品有准确Z值,而331的样品未提供Z值,因此可以证明268为统计样,331为干扰样。通过分析3次能力验证结果得知,|Z|值均小于2.0,证明实验结果相对准确(能力验证评价准则为|Z|≤2.0时,为满意结果;当2.0<|Z|<3.0时,为可疑结果;当|Z|≥3.0时,为不满意结果)。
3 结论与讨论
3.1 讨论
实验中,建议使用一次性无菌平皿,玻璃平皿可能存在不平整现象,影响计数。在开展实验之前,应准备好实验试剂和耗材,提前灭菌。生物安全柜在实验开始之前用紫外灯照射30 min,台面用75%乙醇擦拭一遍。培养箱提前打开并调到所需温度,以保证培养时间达到标准要求,方便计时保证结果准确性。金黄色葡萄球菌定量项目在计数时应详细记录典型的菌落数,进行后续鉴定时,应尽可能地多挑取可疑菌落,以保证取到目标菌,防止挑取的菌种全部都是杂菌而造成假阴性的结果[3]。霉菌与酵母菌的计数中,由于霉菌和酵母孢子会扩散,因此在新版标准GB 4789.15—2016中,明确规定将培养方式调整为正置培养[4]。菌落总数培养时,培养基厚度要适中,如有必要可以再覆盖一层培养基,控制好实验时间,避免时间过长影响计数结果。
微生物实验每个环节都会影响最终的检测结果,因此每一步都应该详细记录下来,以便及时发现问题并改正,在计数过程中每隔一段时间就应该记录,防止时间过长菌落蔓延影响结果。在做实验时应安排人员进行比对,根据不同检验员的结果进行分析,必要时也可以用纸片法进行对比实验。在能力验证过程中可通过安排人员进行比对测试、定量检测结果的不确定度,加强检验过程中的监督与核查,提高检验员自身的实验技能和解决问题的能力,以及实验室的整体检测质量[5]。
3.2 结论
定期参加能力验证能够及时发现实验室问题,对于检验员提高自身技术水平也有很大帮助。营口市食品药品检验检测中心微生物检验室,连续3年参加能力验证,|Z|值均小于2.0,结果均为满意,证明实验室检测结果相对准确,为承担国家抽检任务奠定了良好的基础。
参考文献
[1]杨玉红,吕玉珍.食品微生物与实验实训[M].大连:大连理工大学出版社,2011.
[2]雷质文.食品微生物实验室质量管理手册[M].北京:中国标准出版社,2006.
[3]李文绮,李自芹,贾文婷.2019—2021年食品微生物能力验证的结果分析与讨论[J].农产品加工,2023(3):67-71.
[4]郭丽艳.能力验证样品中霉菌和酵母检测结果的不确定度评定[J].食品安全质量检测学报,2019,10(18):6088-6092.
[5]中国食品药品检定研究院.食品检验操作技术规范(微生物检验)[M].北京:中国医药科技出版社,2019.
作者简介:邵悦(1993—),女,黑龙江兰西人,本科,工程师。研究方向:生物技术、食品微生物。