酵素对黄豆芽生长发育、产量和营养价值的影响
作者: 陈丽瑛
摘 要:本实验将不同酵素浓度培育出的豆芽与促生长激素6-苄氨基嘌呤、赤霉素培育的豆芽进行对比,旨在找到能够代替有害激素对豆芽生长具有促进作用的酵素及适宜的浓度。从实验结果来看,酵素在豆芽培养中的促进作用优于有害激素带来的促进作用,其中酵素550倍稀释液表现最佳。
关键词:黄豆芽;酵素;营养价值
Effect of Enzymes on Growth and Development, Yield and Nutritive Value of Soybean Sprouts
CHEN Liying
(Sendelta International Academy, Shenzhen 518000, China)
Abstract: This experiment compares bean sprouts cultivated with different enzyme concentrations with those cultivated with growth hormone 6-benzylaminopurine and gibberellin, with the aim of finding enzyme and appropriate concentrations that can replace the harmful hormones to promote the growth of bean sprouts. From the results of the experiment, it was found that the enzyme promoted the growth of bean sprouts better than the harmful hormone, and the 550 times dilution of the enzyme showed the best performance.
Keywords: soybean sprouts; enzyme; nutritive value
豆芽在我国已有悠远的食用历史,可食用豆芽大致分为黄豆芽[1-3]、绿豆芽、黑豆芽等种类。其中黄豆芽作为民间最常见的豆芽菜,深受人们的欢迎。黄豆芽味道鲜美、种植周期短,且营养价值较高,如黄豆芽是一种很好的植物性蛋白质来源,还含有丰富的碳水化合物,其中包括淀粉、纤维素等,且富含各种维生素,特别是维生素C、维生素K和叶酸。因此,黄豆芽作为我国常见且有营养的蔬菜之一,有着不可低估的经济价值。某些不法分子因追求利益而滥用对人体有害的激素,快速养殖豆芽,导致了“毒豆芽事件”[4-5],对公众健康造成严重威胁。相关有害激素[6-7]已被禁止用于黄豆芽培养,随着科技的进步,可以研发出新的化学激素替代品[8-9],使黄豆芽在安全条件下仍能快速生长。本研究采用山东省潍坊市金银条豆芽机公司生产的酵素(由果蔬、益生菌、糖和其他原料发酵制成,发酵时间长达3~4年)进行实验。酵素是以果蔬等绿色原料发酵制成,因此不仅环保,而且安全可靠。
为了比较酵素的效果与潜在有害激素,选择了7种酵素稀释倍数、清水,以及6-苄氨基嘌呤(简称6-BA)和赤霉素[10]作为变量进行实验。在养殖5 d后,测量生长数据(茎长、发芽率、含水量、质量[11])、营养指标[(氨基酸[12-18]、可溶性糖[19-21]、蛋白质[22]、抗坏血酸[23-25]、超氧化物歧化酶[26](简称SOD酶)]和有害指标(铅、亚硫酸盐、亚硝酸盐)。其中,生长指标在很大程度上代表豆芽收获后的经济价值。而营养指标[27-29]更多地影响消费者的选择,随着我国经济实力的增长,消费者对蔬菜的营养价值也更加重视。有害指标可以评估豆芽是否有害,尽管酵素的生产过程理论上是无毒无害的,但仍需要客观指标来验证这一事实。
1 材料与方法
1.1 材料与设备
黄豆,购于品牌十月稻田,产地为辽宁沈阳;6-BA、赤霉素,花卉市场;豆芽酵素,山东省潍坊市金银条豆芽机有限公司。
酵素及有害激素的配比:使用的酵素/激素浓度依次为清水、300倍稀释液、350倍稀释液、400倍稀释液、450倍稀释液、500倍稀释液、550倍稀释液、600倍稀释液、6-BA(1 mg·L-1)、赤霉素(300 mg·L-1)。每种浓度所需的水量为4 500 mL(即4.5 L)。
对应每种浓度的酵素或药品的使用量:清水无须添加酵素;300倍稀释液需要添加15.05 mL酵素;350倍稀释液需要添加12.90 mL酵素;400倍稀释液需要添加11.30 mL酵素;450倍稀释液需要添加10.02 mL酵素;500倍稀释液需要添加9.01 mL酵素;550倍稀释液需要添加8.20 mL酵素;600倍稀释液需要添加7.51 mL酵素;6-BA需要添加4.5 mg激素;赤霉素需要添加1 350 mg激素。
1.2 种植前处理
1.2.1 对种子的处理
对黄豆种子进行人工筛选,将不良种子(病种、残缺种)以及杂质剔除。每个变量选取150颗优质豆子,用50 ℃的水对豆子进行烫种杀菌,接着将黄豆种浸泡在不超过它体积两倍的清水里6 h。6 h后将水沥干,将豆种均匀倒入豆芽机育苗盘避光进行培养。
1.2.2 豆芽机自动培养程序
每3 h喷洒一次酵素稀释液或药品。豆芽种植过程中保持25 ℃[30]左右的室温[31],80%~90%的相对湿度。全程避光[15]。
1.3 生长指标测定方法
1.3.1 发芽率测定方法
初始每组为150粒黄豆,发芽率=(150-未发芽黄豆数量)/150×100%。
1.3.2 豆芽茎长测定方法
每个变量随机选取40株豆芽,将豆芽完全舒展,使用游标卡尺测量其茎长。记录数据后,取平均值(cm)。
1.3.3 豆芽质量测定方法
豆芽种植5 d之后,对已长出的豆芽进行清洗,沥干。在分析天平上称取每组豆芽的鲜重。质量(g/100粒)=总质量/150×100。
1.3.4 豆芽含水量测定方法
从每组豆芽中随机选取一半进行再次称重,并记录鲜重。将豆芽放入烘箱,55 ℃烘2~3 d。烘干后测量每组豆芽的干重。含水量=(鲜重-干重)/鲜重×100%。
1.4 营养指标测定
1.4.1 游离氨基酸测定
(1)试剂制备[32-35]。亮氨酸标准溶液(1 μmol·mL-1):0.032 8 g亮氨酸(分析纯)定容250 mL。乙酸-乙酸钠缓冲液(pH值5.4~5.6):将6.8 g乙酸钠用水溶解,定容至250 mL,2.89 mL乙酸用水定容至250 mL;用移液枪吸取6.8 mL的乙酸钠溶液与43.2 mL乙酸溶液混匀,得到pH值5.4~5.6的乙酸-乙酸钠缓冲液。3%茚三酮:将3 g茚三酮晶体溶于2 mL95%酒精中,再加水定容100 mL。0.1%抗坏血酸:称取0.1 g抗坏血酸,定容至250 mL。
(2)标准曲线绘制。取6只15 mL的离心管,在试管编号为1~6的不同试管中,分别加入0 mL、0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL标准氨基酸溶液,对应依次分别加入0.5 mL、0.4 mL、0.3 mL、0.2 mL、0.1 mL、0 mL的蒸馏水,并均加入0.5 mL乙酸-乙酸钠缓冲液、0.5 mL3%茚三酮、50 μL的0.1%抗坏血酸,混匀,接着将把离心管放入85 ℃的水浴锅水浴12 min。水浴后立即放入冰水中进行冷却。并在冰水中向各管中加入5 mL 95%的酒精。在摇床上进行混匀,溶液此时呈现蓝紫色。将溶液转移至10 mL容量瓶进行定容。吸取0.3 mL处理后的标准溶液,加入2.7 mL蒸馏水进行10倍稀释。在570 nm的紫外分光光度计上测量吸光值,以氨基酸浓度为横坐标,检测出的吸光值为纵坐标,绘制标准曲线。
(3)豆芽的氨基酸测定。精密称取烘干后的豆芽粉末0.4 g,将其置于250 mL圆底烧瓶中,加水煎煮3次,第1次加入水40 mL,煎煮1.0 h,趁热抽滤,收集滤液,保留滤渣;第2次向滤渣精密加入水20 mL,煎煮0.5 h,趁热抽滤,收集滤液,保留滤渣;第3次向滤渣精密加入水20 mL,煎煮0.5 h,趁热抽滤,保留滤液。合并3次滤液,倒入100 mL容量瓶中,加水定容,此为豆芽氨基酸提取液。吸取0.5 mL豆芽提取液于15 mL离心管中,依次加入无氨蒸馏水0.5 mL、乙酸-乙酸钠缓冲液0.5 mL、3%茚三酮0.5 mL、0.1%抗坏血酸0.05 mL,混匀。将离心管放入85 ℃水浴12 min,冷却后于每管中加入95%乙醇5 mL,置于摇床上混匀,定容至10 mL后测其吸光值。
1.4.2 可溶性糖测定
(1)试剂制备。葡萄糖标准溶液母液(500 μg·mL-1):将50 mg葡萄糖用水定容至100 mL[36-37]。蒽酮溶液(20 mg·mL-1):取40 mg蒽酮,溶于2 mL乙酸乙酯中。
(2)可溶性糖标准曲线绘制。分别吸取0 μL、50 μL、100 μL、150 μL、200 μL的 葡萄糖母液至玻璃离心管,用清水补齐500 μL,配制成葡萄糖含量为0 μg·mL-1、25 μg·mL-1、50 μg·mL-1、75 μg·mL-1、100 μg·mL-1的葡萄糖标准溶液。分别加入蒽酮溶液100 μL和浓硫酸1 000 μL,混匀后置于沸水水浴7 min。水浴后在冰盒中冷却10 min。吸取0.3 mL处理后的标准溶液,加入2.7 mL蒸馏水进行10倍稀释。稀释后在620 nm波长下的分光光度计测定吸光值。
(3)豆芽的可溶性糖检测。称取烘干后的豆芽干粉1 g,置于含有10 mL蒸馏水的玻璃离心管中。将玻璃离心管放入沸水中水浴10 min。取出后冷却过滤,得可溶性糖提取液。吸取500 μL的可溶性糖提取液置于新的玻璃离心管中,加入蒽酮溶液100 μL和浓硫酸1 000 μL,混匀放入沸水水浴7 min。水浴后在冰盒中冷却10 min,吸取0.3 mL处理后的可溶性糖检测溶液,加入2.7 mL蒸馏水进行10倍稀释。稀释后在620 nm波长下的分光光度计测定吸光值。
1.4.3 蛋白质测定
参考国家标准《食品安全国家标准 食品中蛋白质的测定》(GB 5009.5—2016)第一法。
1.4.4 抗坏血酸测定
参考国家标准《食品安全国家标准 食品中抗坏血酸的测定》(GB 5009.86—2016)第三法。
1.4.5 SOD酶测定
采用上海索桥生物科技有限公司超氧化物歧化酶试剂盒(货号:QS1500)进行检测。
1.5 有害物质测定
1.5.1 亚硫酸盐测定
参考国家标准《食品安全国家标准 食品中二氧化硫的测定》(GB 5009.34—2022)。
1.5.2 亚硝酸盐
参考国家标准《食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定》(GB 5009.33—2016)第二法。
1.5.3 铅含量测定
参考国家标准《食品安全国家标准 食品中铅的测定》(GB 5009.12—2017)第二法。
2 结果与分析
2.1 生长指标结果
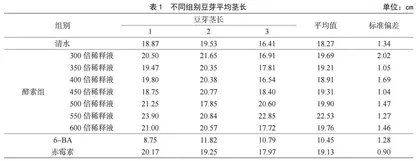
2.1.1 酵素浓度对茎长的影响