牛奶中黄曲霉毒素M族检测能力验证及创建二级全扫描质谱图
作者: 郑平 王冬 邹康平 陈斐 赵宇凡 荆振杨
摘 要:目的:验证本检验结构是否有能力按照《食品安全国家标准 食品中黄曲霉毒素M族的测定》(GB 5009.24—2016)中第一法开展牛奶中黄曲霉毒素M1、M2的检验。方法:使用超高效液相色谱串联质谱法进行分析检测,通过验证该方法的线性范围、定量限、正确度和精密度等指标,然后建立液相色谱四极杆串联离子阱复合质谱法,采用多反应监测-信息关联-增强子离子扫描模式(MRM-IDA-EPI),创建黄曲霉毒素M1、M2的二级全扫描质谱图。结果:黄曲霉毒素M1、M2在0.015~0.500 μg·kg-1有良好的线性,相关系数在0.995以上,方法定量限满足标准要求,平均回收率在97.0%~108.0%、相对标准偏差≤20%。结论:本实验室具备开展牛奶中黄曲霉毒素M1、M2检测的能力,同时应用离子阱复合质谱特有的MRM-IDA-EPI扫描模式,可实现对牛奶中黄曲霉毒素M1、M2的筛查、确证。
关键词:超高效液相色谱串联质谱法;同位素内标;黄曲霉毒素M1;黄曲霉毒素M2;方法验证;二级质谱图
Abstract: Objective: To verify the ability of this inspection structure to comply with GB 5009.24—2016 First method for testing aflatoxin M1 and M2 in milk. Method: High performance liquid chromatography-isotope dilution mass spectrometry for analysis, the method was verified by examining the linear range, method quantitative limit, correctness and precision. Then the method of ultra performance liquid chromatography-Q-trap-tandem mass spectrometry (UPLC-Q-Trap-MS) was established by MRM-TDA-EPI scanning mode ,to get second-order full-scan mass spectra. Result: Aflatoxin M1 and M2 had a good linear relationship in the range of 0.015~0.500 μg·kg-1, the correlation coefficient was above 0.995, the quantification limit of the method met the requirements, the average recovery rate was 97.0%~108.0%, and the relative standard deviation was less than or equal to 20%. Conclusion: The laboratory has the ability to carry out the determination of in milk. The MRM-IDA-EPI scanning mode of liquid chromatography quadrupole tandem ion trap composite mass spectrometry was used to realize the screening and confirmation of suspicious peaks.
Keywords: high performance liquid chromatography-tandem mass spectrometry; isotopic internal standard; aflatoxin M1; aflatoxin M2; method validation; second-order mass spectra
黄曲霉毒素(Aflatoxin,AFT)属于双呋喃环类毒素,是一种次级代谢产物,由黄曲霉和寄生曲霉等某些菌株产生,约有20种衍生物,会对人和动物造成严重危害[1]。饲料受到黄曲霉毒素B1、B2污染,被动物食用,会代谢产生黄曲霉毒素M1、M2[2],这些代谢产物会存在于乳、蛋、尿和肉中,最常见的是乳及乳制品中[3]。《食品安全国家标准 食品中真菌毒素限量》(GB 2761—2017)中规定,乳制品中黄曲霉毒素M1的限量不得超过0.5 μg·kg-1,目前关于奶及奶制品中对黄曲霉毒素B1和M1的研究较多[4-6],而对黄曲霉毒素M1、M2同时检测的研究较少。同时由于食品基质的复杂性,基质效应可能会导致假阳性的发生,而离子阱串联质谱法能获得目标离子的二级质谱图,可以对目标化合物进一步定性[7]。目前使用该模式同时检测牛奶中黄曲霉毒素M1和黄曲霉毒素M2的研究较少。本研究主要对GB 5009.24—2016第一法进行验证,确保本检验机构能对牛奶中AFTM1和AFTM2进行准确检测。同时利用仪器自带的离子阱功能(Q-Trap),建立黄曲霉毒素M1、M2的二级全扫描质谱图,对样品中是否含有目标物质进行进一步定性、确认。
1 材料与方法
1.1 材料和试剂
所用牛奶样品(预包装)均为江苏省常州市金坛区市售;甲醇、乙腈(色谱纯,德国默克公司);乙酸铵(色谱纯,上海麦克林生化科技有限公司);氯化钠、十二水和磷酸氢二钠、磷酸二氢钾和氯化钾(分析纯,成都市科龙化工试剂厂);盐酸(分析纯,天津科密欧试剂公司);黄曲霉毒素M1(C17H12O7)标准品5 μg·mL-1、黄曲霉毒素M2标准品(C17H14O7)10 μg·mL-1和13C17-AFTM1同位素溶液(13C17H14O7)0.5 μg·mL-1,均购自坛墨质检标准物质中心。
1.2 仪器和设备
电子天平AB265-S(精度:0.000 01 g,梅特勒-托利多科技(中国)有限公司);全自动固相萃取仪、全自动氮吹器(睿科集团股份有限公司);Sciex Qtrap-4500超高效液相色谱串联质谱仪(带离子阱)(上海爱博才思仪器贸易有限公司);全自动离心机(上海手术器械厂);黄曲霉毒素M族免疫亲和柱(3 mL,柱容量≥150 ng)(涿州凯斯科生物技术有限公司)。
1.3 试验方法
1.3.1 样品前处理
样品提取和净化步骤严格按照《食品安全国家标准 食品中黄曲霉毒素M族的测定》(GB 5009.24—2016)第一法中5.1.1和5.2.2进行。空白实验:在不取样的情况下,按照上述提取和净化程序进行空白试验,需要确认不含有干扰待测成分的物质,上述前处理需全程避光。
1.3.2 色谱条件
色谱柱:C18色谱柱(100 mm×3 mm,2.6 µm);柱温:40 ℃;流动相:A为5 mmol·L-1乙酸铵溶液,B为乙腈+甲醇(50+50);流速:0.3 mL·min-1;洗脱方式:梯度洗脱。
1.3.3 质谱条件
离子源:电喷雾离子源;正模式扫描;多反应监测(MRM)模式采集;气帘气(CUR):30 psi;雾化气(GS1):50 psi;辅助气(GS2):50 psi;碰撞气(CAD):medium;离子喷雾电压:4 500 V;辅助气温度(TEM):550 ℃。优化仪器条件,使目标色谱峰的灵敏度最高。
1.3.4 方法学验证
按照《实验室质量控制规范 食品理化检测》(GB/T 27404—2008)附录F和《食品安全国家标准 食品中黄曲霉毒素M族的测定》(GB 5009.24—2016)中第一法的要求,本试验方法验证主要包括下面几项。
(1)校准曲线验证。配制AFTM1和AFTM2的浓度均为0.05 μg·L-1、0.40 μg·L-1、0.80 μg·L-1、1.00 μg·L-1、2.00 μg·L-1、4.00 μg·L-1、6.00 μg·L-1和8.00 μg·L-1,13C17-AFTM1浓度为0.45 μg·L-1的系列标准溶液,供HPLC-MS/MS测定,得到标准曲线回归方程,其线性相关系数r应大于0.99。
(2)准确度验证。牛奶中黄曲霉毒素M1限量为0.5 μg·kg-1,目前我国对黄曲霉毒素M2的限量没有明确规定,GB 5009.24—2016中第一法中规定AFTM1和AFTM2的定量限均为0.015 μg·kg-1。因此称取18份阴性牛奶样品,依次添加0.015 μg·kg-1、0.100 μg·kg-1和0.500 μg·kg-1共3个水平浓度,每个水平需做6次重复试验,进行准确度验证。
(3)方法定量限验证。定量限是信噪比等于10时的浓度,该标准方法规定AFTM1和AFTM2的定量限均为0.015 μg·kg-1。称取2份阴性牛奶样品,分别添加0.015 μg·kg-1的AFTM1和AFTM2,进行处理,测定。如果2份加标样品中AFTM1和AFTM2的信噪比S/N均>10,证明可以满足方法定量限要求。
(4)精密度验证。称取3份阴性牛奶样品,依次添加0.015 μg·kg-1、0.100 μg·kg-1和0.500 μg·kg-1共3个水平浓度,上机重复测定次数至少为6次,计算实验室内变异系数。
1.3.5 创建目标物质二级质谱图
在上述仪器条件基础上建立多反应监测触发增强子离子扫描模式(MRM-IDA-EPI),设定信息依赖触发阈值:1 000 cps;动态背景扣除模式;子离子扫描速度10 000 Da·s-1,扫描范围50~350(m/z);EPI:1个;碰撞能量为35 V。建立黄曲霉毒素M1、M2的二级全扫描质谱图,获得更全面的碎片信息。
2 结果与分析
2.1 工作曲线及线性相关系数验证结果
按照设定的仪器方法,将标准系列溶液从低到高浓度进行检测,以AFTM1和AFTM2色谱峰与13C17-AFTM1峰面积比值-浓度比值作图,得到AFTM1和AFTM2的标准曲线方程分别为y=2.717 51x-0.005 56和y=2.052 21x+0.017 64,相关系数r分别为0.999 01和0.999 17,满足r>0.99的要求。
2.2 方法准确度验证结果
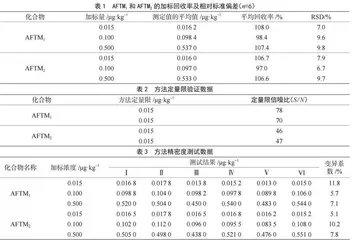
以阴性样品加标回收率来验证方法的准确度,在阴性牛奶样品中分别添加0.015 μg·kg-1、0.100 μg·kg-1和0.500 μg·kg-13水平浓度的黄曲霉毒素M1、M2,每个水平需做6次重复试验,加标回收率结果见表1。加标量在0.015~0.500 μg·kg-1时,平均回收率为97.0%~108.0%,相对标准偏差(RSD)≤20%,满足《实验室质量控制规范 食品理化检测》(GB/T 27404—2008)附录F中关于浓度小于0.1 mg·kg-1时,回收率满足60%~120%的要求。
2.3 方法定量限验证结果
由表2可知,该方法中AFTM1和AFTM2定量限0.015 μg·kg-1处的信噪比(S/N)为46~78,均大于10,表明按照上述前处理步骤处理样品,可以满足标准方法中规定的定量限。
2.4 方法精密度验证结果
由表3可知,在阴性牛奶样品中添加黄曲霉毒素M1、M2 0.015 μg·kg-1、0.100 μg·kg-1和0.500 μg·kg-1共3个水平进行6次重复试验,计算得到实验室变异系数为5.1%~11.8%,满足GB/T 27404—2008附录F当被测组分含量≤1.0 μg·kg-1时,变异系数≤30%的要求。