高效液相色谱-串联质谱法测定婴幼儿配方乳粉中A1 β-酪蛋白、A2 β-酪蛋白含量
作者: 羊银 张瑞华 刘莹
摘 要:建立婴幼儿配方乳粉中A1、A2 β-酪蛋白的高效液相色谱-串联质谱测定方法。乳粉经尿素溶液溶解稀释,胰蛋白酶酶解,过膜后利用ACQUITY UPLC Peptide BEH C18(100 mm×2.1 mm,1.7 μm)色谱柱分离,0.1%甲酸水、0.1%甲酸乙腈为流动相梯度洗脱,高效液相色谱-串联质谱仪测定。结果表明,A1、A2 β-酪蛋白在0.02~2.00 mg·mL-1线性范围内,相关系数(R2)均≤0.99,检出限为0.05~0.10 g·kg-1;定量限为0.2~0.5 g·kg-1;平均回收率在92.08%~105.29%;平均相对标准偏差为1.5%~7.9%。随机选取了10个品牌的婴幼儿配方乳粉进行测定,得到A1 β-酪蛋白、A2 β-酪蛋白的含量在0~30.3 g·kg-1。
关键词:婴幼儿配方乳粉;A2 β-酪蛋白;A1 β-酪蛋白;高效液相色谱-串联质谱法
Determination of A1 and A2 β-Casein in Infant Formula Milk Powder by High Performance Liquid Chromatography-Tandem Mass Spectrometry
YANG Yin, ZHANG Ruihua, LIU Ying*
(Tianjin Institute for Food Safety Inspection Technology, Tianjin 300308, China)
Abstract: To establish a method based on high performance liquid chromatography-tandem mass spectrometry(HPLC-MS/MS)to detect A1 and A2 β-casein in infant formula milk powder. The milk powder was dissolved and diluted in urea solution, hydrolyzed with trypsin, and filtered to be determined. The samples were separated on ACQUITY UPLC Peptide BEH C18 (100 mm×2.1 mm, 1.7 μm) column by water containing 0.1%(by volume) formic acid and methanol containing 0.1%(by volume) formic acid, and determined by HPLC-MS/MS. The results showed that the correlation coefficients (R2) of A1 and A2 β- casein were all greater than 0.99 in the corresponding linear range of 0.02~2.00 mg·mL-1. The limits of detection ranged from 0.05 to 0.10 g·kg-1. The limits of quantitation ranged from 0.2 to 0.5 g·kg-1. Average recovery rate were 92.08%~105.29%, relative standard deviation was 1.5%~7.9%. The contents of A1 β- casein and A2 β- casein ranged from 0 to 30.3 g·kg-1 in 10 brands of infant formula milk powder.
Keywords: infant formula milk powder; A2 β-casein; A1 β-casein; high performance liquid chromatography-tandem mass spectrometry
酪蛋白是广泛存在于牛乳、羊乳及人乳等乳及其制品中的一类蛋白质,是由多种不同的氨基酸组成的多肽链,具有抗菌、免疫调节、营养供给等多种生物活性。根据其蛋白序列结构和功能,酪蛋白主要被分为αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白、k-酪蛋白、β-乳球蛋白、血清白蛋白等,其中β-酪蛋白是目前备受关注的酪蛋白[1]。β-酪蛋白有A1和A2两种主要的变异形式。目前有报道称,A1 β-酪蛋白中的β-外啡肽(BCM-7)与1型糖尿病、自身免疫和心血管疾病的发病率也有很强的相关性。研究还发现,自闭症儿童尿液中BCM-7水平显著高于健康儿童,且病情严重程度与BCM-7水平呈正相
关[2-3]。研究表明,患有神经、胃和免疫疾病的患者在食用含A2 β-酪蛋白的牛奶后症状减轻[4]。在许多国家,只含有A2 β-酪蛋白的牛奶和乳制品被标记为A2产品,以供消费者有针对性地选择。因此,测定β-酪蛋白的变异形式对食品生产企业和消费者都具有重要意义。
目前,测定牛奶或各种乳制品中β-酪蛋白变异型的方法较多,例如,利用毛细管区带电泳(Capillary Zone Electrophoresis,CZE)法测定液态奶及奶粉中A2 β-酪蛋白和总β-酪蛋白[5];尿素-聚丙烯酰胺电泳法可以用来区分牛奶中A1和A2 β-酪蛋白变异型;聚合酶链反应(Polymerase Chain Reaction,PCR)结合高分辨率熔解法也被用于鉴定β-酪蛋白变异型。近年来,液相色谱-质谱联用技术以其高灵敏度、高精度、高专一性等优点被广泛应用于各个领域。液相色谱法具有分离牛奶中不同蛋白质的能力,而高分辨率质谱法在测定完整蛋白质分子量方面具有高特异性和高灵敏度的优点。然而,用液相色谱法完全分离完整的酪蛋白变体非常困难,因为其物理和化学性质极为相似。此外,直接检测完整酪蛋白的分子量对质谱仪的质量范围和电离性能提出了很高的要求,而通过酶消化后检测特征肽来确定变异体更为可行。
本研究考虑到A1和A2 β-酪蛋白变体的区别在于序列中第67位的氨基酸片段,经酶切后观察到A1和A2 β-酪蛋白的特征肽在组成和长度上存在明显差异,便于液相色谱分离。同时,较短的特征肽有利于质谱检测。本文建立了一种高效液相色谱-串联质谱法(High Performance Liquid Chromatography-Tandem Mass Spectrometry,HPLC-MS/MS)测定婴幼儿配方乳粉中A1和A2 β-酪蛋白的检测方法。这些特征肽在电喷雾电离(ESI)模式下通过MS/MS实验进行分析,进一步增加了方法的特异性,从而提高了结果的可靠性。此外,通过对市售的10种婴幼儿配方乳粉进行检测,结果表明,该方法具有高特异性、高灵敏度、高效率的优点,有利于对宣称A2奶的婴幼儿配方乳粉进行质量检测。
1 材料与方法
1.1 仪器与试剂
高效液相色谱-串联质谱仪1290-6470,美国Agilent公司;Milli-Q超纯水系统,美国Millipore公司;Vortex-5涡旋仪,江苏海门其林贝尔仪器制造有限公司;超声波清洗机,江苏张家港三友超声设备有限公司;BSA224S-CW型电子天平,德国赛多利斯;ACQUITY UPLC Peptide BEH C18(100 mm×2.1 mm,1.7 μm),美国waters公司;甲醇(色谱纯),德国默克公司;乙腈(色谱纯),美国Fisher公司;碳酸氢钠(分析纯),中国安谱公司;尿素,阿拉丁;甲酸(色谱纯),默克;牛β-酪蛋白(含量≥95%),SIGMA;牛β-酪蛋白同位素标记特异肽标准品(纯度≥90%),上海杰肽;胰蛋白酶(每毫克活力大于10000BAEE,1 g),YAXINBIO;超纯水(一级水)电阻18.2 MΩ,25 ℃。
1.2 实验方法
1.2.1 色谱条件
流动相A为体积分数0.1%甲酸水溶液,流动相B为0.1%甲酸乙腈;色谱柱:ACQUITY UPLC Peptide BEH C18(100 mm×2.1 mm,1.7 μm);色谱柱温40 ℃;进样体积10 μL;流速0.3 mL·min-1;色谱梯度洗脱条件:B相初始浓度为5%;0~1.0 min,5%B ;1.0~5.0 min,5%→40%B;5.0~5.5 min,40%→100%B;5.5~7.0 min,保持100%;7.0~
7.5 min,100%→5%B;7.5~10.0 min,保持5%。
1.2.2 质谱条件
电喷雾离子源;扫描方式:正/负离子扫描;扫描范围:m/z 50~1 200;毛细管电压:+3 500 V/
-3 000 V;喷嘴电压:+0 V/-500 V;干燥气温度:250 ℃;干燥气流速:6.0 L·min-1;雾化气压力:
30 psi;鞘气温度:325 ℃;鞘气流速:11.0 L·min-1。
1.2.3 样品前处理
准确称取样品1.0 g(精确至0.01 g),用
6 mmol·L-1尿素溶液溶解定容至100 mL,超声溶液10 min。取100 μL样品于2 mL离心管中,加入50 μL
同位素标记特异肽混合工作溶液,820 μL碳酸氢化缓冲溶液(100 mmol·L-1),加入1 mg·L-1的胰蛋白酶20 μL于37 ℃恒温酶解6 h,完成后取出加10 μL甲酸混匀,室温静置30 min,过膜后经高效液相色谱-串联质谱仪测定。
2 结果与分析
2.1 质谱测定条件建立和应用
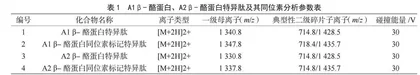
对牛β-酪蛋白酶解特异肽及其同位素内标液进行分析,根据其化合物结构特征对应的质谱行为进行一级质谱分析,得到分子离子峰;优化其锥孔电压使其分子离子峰强度最大;再对分子离子进行二级质谱分析,选取丰度较强、干扰较小的离子作为定性、定量离子并优化其碰撞能量,得到的质谱参数见表1。选择ACQUITY UPLC Peptide BEH C18色谱柱进行分离,结果显示,在设定的洗脱程序及表1所示的质谱参数下,A1 β-酪蛋白、A2 β-酪蛋白能得到良好的分离和定性定量确证。
2.2 定性分析
根据A1、A2 β-酪蛋白的结构特征,选择正模式进行电离,并根据其响应的强度,选择了表1中的离子对来进行定性和定量分析。由图1可知,在上述设定的色谱质谱条件下, A1 β-酪蛋白水解特异肽的保留时间为5.911 min,其离子丰度比值为21.3;A2 β-酪蛋白水解特异肽的保留时间为6.140 min,其离子丰度比值为20.7。从图1可知,该色谱条件下,A1、A2 β-酪蛋白特异肽实现了良好的分离,加标回收试验得到的离子丰度比值介于20.1~21.5,满足质谱定性要求的离子丰度比允许相对偏差±25%的要求。
2.3 方法学验证
2.3.1 线性范围、标准曲线、检出限与定量限
通过简单稀释的方法,用水将高浓度的A1 β-酪蛋白、A2 β-酪蛋白配制成浓度为0.02 mg·mL-1、
0.05 mg·mL-1、0.10 mg·mL-1、0.50 mg·mL-1、
1.00 mg·mL-1、1.50 mg·mL-1和2.00 mg·mL-1的标准工作溶液,分别取100 μL,按照1.2.3进行酶解反应,得到外标浓度为0.002~0.200 mg·mL-1,同位素特异肽的浓度为0.002 5 mg·mL-1的工作曲线。通过Agilent 1290 -6470型号液质进行检测,建立含量为横坐标(X,ng·mL-1),峰面积为纵坐标Y的标准曲线。结果显示,A1 β-酪蛋白、A2 β-酪蛋白在0.02~2.00 mg·mL-1,线性相关系数R2≥0.99,其线性方程、线性范围、相关系数R2、LOD、LOQ见