SDS-PAGE法对乳及乳制品中主要蛋白的定性和定量分析
作者: 刘利娟
婴幼儿配方奶粉是以母乳为标准,选自优质乳牛的奶源,对牛奶的主要蛋白质成分调整,使其最大限度地接近母乳,从而更适合婴儿的肠胃吸收和营养需求。牛乳中的蛋白质主要分为酪蛋白和乳清蛋白两个重要组成部分,其中酪蛋白占乳总蛋白含量约80%,酪蛋白主要包含αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白和Ƙ-酪蛋白四种蛋白质,分别占总酪蛋白的比例为4:1:4:1,乳清蛋白占乳总蛋白含量约20%,乳清蛋白主要由α-乳白蛋白(Q-LA)、β-乳球蛋白(B-LG)、免疫球蛋白(Ig)和牛血清蛋白(BSA)组成,分别占总乳清蛋白的5:2:8:5。其中,α-乳白蛋白含有丰富的色氨酸,能够促进婴儿的神经发育,易被肠道消化吸收,且不易引起婴儿过敏。为了使婴儿配方奶粉的营养成分更接近母乳,通常会特别添加α-乳白蛋白,且通过调节其他蛋白质的比例,为婴儿提供更健康营养的食品。
目前对牛乳中蛋白质含量检测的方法较多,包括凯氏定氮法、SDS-PAGE电泳法、双缩脲法、分光光度法、高效液相色谱法等。凯氏定氮法主要用于乳品中总蛋白的含量测定,其他方法不能够实现不同种类蛋白质的有效分离,高效液相色谱虽然检测精确度较高,但存在检测成本高、样品前处理麻烦、不能同时测定多种蛋白质含量等缺点。本研究旨在通过方法优化,获得操作简单、成本低,能够实现同时测定多种乳及乳制品中主要蛋白质的检测方法,为调整婴幼儿配方奶粉中主要酪蛋白和乳清蛋白的比例提供技术参考。
1. 材料与方法
1.1 仪器与设备
凝胶电泳仪(美国伯乐BIO-RAD公司);凝胶成像分析仪(美国伯乐BIO-RAD公司);双垂直电泳槽(美国伯乐BIO-RAD公司);MO10型定轨摇床(德国LABSTAR的公司)。
1.2 材料与试剂
α-酪蛋白标准品(sigma公司,纯度≥70%);β-酪蛋白标准品(sigma公司,纯度≥98%);κ-酪蛋白标准品(sigma公司,纯度≥70%);α-乳白蛋白(sigma公司,纯度≥85%);β-乳球蛋白(sigma公司,纯度≥90%);标准电泳蛋白Maker(sigma公司,6.5-200ku);鲜牛乳;婴幼儿配方奶粉。
电泳储备液:30%丙烯酰胺单体储备液、分离胶缓冲液(1.5M Tris-HCl pH 8.8)、浓缩胶缓冲溶液(0.5M Tris-HCl pH 6.8)、10%SDS 、双蒸水、10%过硫酸、TEMED(四甲基乙二胺)。
样品缓冲液:取浓缩胶缓冲液12.5mL、SDS 2g、β-巯基乙醇15mL、甘油10mL和溴酚蓝0.2g,用双蒸水定容至100mL,-20℃保存。
电极缓冲液(pH8.3):将1.0gSDS、3.0gTris 和14.4g甘氨酸溶于900mL 去离子水,用去离子水定容至1000mL。
染色液:取10mL 冰乙酸、45mL 乙醇和0.2g 考马斯亮蓝R-250,用去离子水定容至100mL;脱色液:取100mL冰醋酸和200mL乙醇,用去离子水定容至1000mL。
1.3 实验方法
1.3.1 样品的前处理
量取10mL鲜牛乳样品,样品在10000r/min转速下离心15min,去除脂肪层,留取清液备用,清液、水、样品缓冲液以1:1:2的混合,沸水浴加热10min,10000r/min离心10min,取清液分装,备用。
称取1g婴幼儿配方奶粉样品,用双蒸水定容至10mL,10000r/min,转速下离心15min,步骤同鲜牛乳样品。
1.3.2 电泳条件
配制15%分离胶:30%丙烯酰单体胺储备6mL,分离胶缓冲液3mL,10%SDS120μL,双蒸水3mL,10%过硫酸铵60μL,TEMED 6μL。
配制4%浓缩胶:30%丙烯酰单体胺储备0.67mL,浓缩胶缓冲液1mL,10%SDS40μL,双蒸水3.33mL,10%过硫酸铵30μL,TEMED 10μL。
将制备好的胶放入电泳槽内,加入电极缓冲液,将梳子垂直缓慢地拔出,分别对样品和标准品进行不同浓度、不同体积进样。预电泳电压80V,分离胶与浓缩胶分界处改为130V电压完成电泳。0.1%考马斯亮蓝溶液染色1h,脱色液洗脱过夜,至凝胶背景为透明无色。
2. 结果与分析
2.1 分离胶浓度的选择
SDS-聚丙烯酰胺凝胶电泳有两种系统,即只有分离胶的连续系统和有浓缩胶与分离胶的不连续系统。本实验采用不连续系统的优点在于样品可以在进入分离胶之前在浓缩胶上达到相同的速度,即使样品达到相同的初速度和初始值。带电胶粒在电场作用下向着与自身相反的电荷方向移动,且分子量越小的粒子,受到的阻力越小,分子迁移的速度越快,分子量越大的粒子收到的阻力越大,迁移速度越慢,这样蛋白质通过电泳因分子量的不同得到分离。将样品稀释相同的倍数、相同的电泳条件、不同的分离胶浓度,即分别为5%、10%、15%、25%进行实验,结果显示,5%的分离胶的阻碍作用较弱,图像比较模糊,颜色较浅;12%和20%的分离胶具有较小的孔径,较能起到分子筛的作用,图像颜色较深、清晰度较好,15%的分离胶浓度条带最清晰,各蛋白的迁移距离较短,电泳的时间较适中。
2.2 样品前处理的选择
处理一:液体样品、水、样品缓冲液混合比例为1:1:2,沸水浴5min,离心5min,去除脂肪,取上清液分装,在-20℃保存,备用。称取固体样品1.0000g,加水定容至10mL,同上液体样品处理方法。该前处理方法跑出了7条蛋白条带,但β-酪蛋白和κ-酪蛋白没有得到很好的分离。
处理二:取1mL的鲜牛乳、酸奶,0.1g/mL婴幼儿奶粉复原乳于离心管内,用尿素稀释8倍,分别取样品80µL加入20µL上样缓冲液,摇匀,沸水浴10min,离心10000r/min,5min。该前处理方法出现5条蛋白条带,其中κ-酪蛋白、α-乳白蛋白均未出现,因此该前处理方法分离效果不好。
处理三:前处理方法同上述1.3.1,此前处理方法出现9条蛋白条带,其中主要的五种蛋白均清晰呈现,即α-酪蛋白(其中包括αs1-酪蛋白、αs2-酪蛋白)、β-酪蛋白、κ-酪蛋白、β-乳球蛋白、α-乳白蛋白,处理方法最佳。
2.3 上样量的确定
按照1.3.1样品的前处理方法对方法进行进一步的优化,将样品稀释成8倍的浓度,分别对样品上样12µL 、10µL、8µL、5µL对电泳图谱进行光密度扫描,结果显示上样量为12µL时图中跑出7种蛋白,但峰展宽较宽,尤其第7条带出现平头峰,故样品进样量太大;上样量为8µL和5µL时,乳清蛋白没有测出,说明样品浓度太小,乳清蛋白不易被检出,上样量为10µL时,电泳图谱共跑出9条带,分离度非常好,故确定最佳上样量为10µL。
2.4 标准曲线的绘制及线性范围的确定
按照1.3.1的前处理方法处理标准品,分别进样10µL、9µL、8µL、7µL、6µL、5µL、4µL、3µL、2µL,通过凝胶成像分析仪分析图像,利用AlphaView-AlphaImager HP软件计算出灰度值,通过灰度值和进样量的关系,以上样量为横坐标,灰度值为纵坐标,绘制标准曲线。α-酪蛋白标准品回归方程y=365.48x+415.26,线性范围1.1-5µg,相关系数0.9957;β-酪蛋白标准品回归方程y=219.64x+112.93,线性范围1.1-5µg,相关系数0.9921;α-乳白蛋白标准品回归方程y=584.38x+343.06,线性范围1.1-5µg,相关系数0.9907;β-乳球蛋白标准品回归方y=781.19x+168.41,线性范围0.5-1.5µg,相关系数0.9954;牛血清蛋白标准品回归方程y=922.61x+103.13,线性范围0.4-1.6µg,相关系数0.9957。
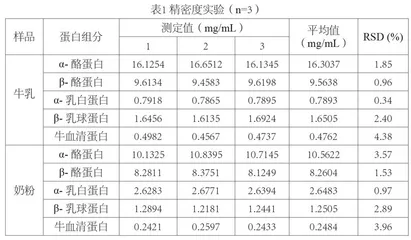
2.5 精密度实验
在同一块胶上每种样品进样10µL,平行上样3次,按照1.3.1的实验方法进行电泳,结束后通过凝胶成像仪对凝胶板进行分析,计算得灰度值带入标准曲线,求得样品中蛋白的含量,结果如下表1所示。
由表1可知,奶粉中α-乳白蛋白的含量比牛乳中的高,是由于为了帮助宝宝对营养的消化吸收,婴幼儿配方奶粉中添加了α-乳清蛋白的缘故,而奶粉样品的其他各蛋白组分的含量比牛乳的偏低,可能是由于奶粉处理过程中会有部分损失,或者奶粉中添加了其他的营养成分,导致蛋白含量相对较低。
2.6 回收率实验
分别将鲜牛乳和婴幼儿配方奶粉样品平均分成三份,分别加入三个质量梯度的蛋白质标准品,计算出方法的加标回收率。如下表2所示。
由表2可知,鲜牛奶和婴幼儿配方奶粉中五种蛋白的加标回收率在87.54%-104.68%之间,RSD值在0.79%-4.49%之间,方法回收率良好。
3. 结果与讨论
本研究建立了SDS-PAGE法对鲜牛乳、婴幼儿配方奶粉内主要蛋白质成分的定性和定量分析。通过优化试验条件,实现了α-酪蛋白、β-酪蛋白、α-乳白蛋白、β-乳球蛋白和牛血清蛋白的分离,并对五种蛋白质进行了定量分析。五种蛋白质测定的R2值均大于0.99,线性关系良好,精密度实验中RSD范围在0.34%-4.38%之间,实验精确度良好,加标回收率范围为87.54%-104.68%。实验结果表明,本研究建立的实验条件,可以对乳及乳制品中的主要蛋白质进行定性和定量分析,并能够实现操作简便、成本低、同时测定乳及乳制品中多种蛋白质,能够为调整婴儿配方奶粉中的蛋白质比例提供有力的技术支持。