番茄青枯病拮抗菌的筛选鉴定及其复配能力研究
作者: 谭泽宝 桓宝林 肖琴 黄文静 罗坤
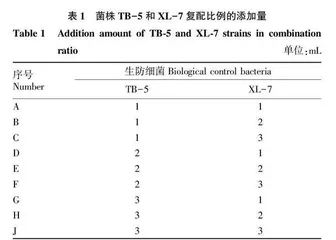
摘要 [目的]筛选出具有广谱抗性的生防细菌,并找到彼此间无抗性且提高番茄青枯病防效的复配菌株。[方法]使用抑菌圈法、琼脂扩散法从湖南长沙青枯病发病田的健康番茄植株茎基部筛选出对青枯雷尔氏菌具有拮抗能力的菌株,通过形态学观察、16S rRNA基因测序、系统发育分析确定其分类地位;以胞外产酶能力测定和抑菌谱测定探究生防菌株的更多功能。[结果]从筛选出的16株具有拮抗能力的菌株中确定了2株生防细菌具有高效的拮抗能力且在复配能力探究中表现出无相异性,筛选到的TB-5被初步鉴定为莫海威芽孢杆菌(Bacillus mojavensis),其对番茄青枯病的抑菌圈大小为21.7 mm;筛选到的XL-7被初步鉴定为暹罗芽孢杆菌(Bacillus siamensis),其对番茄青枯病的抑菌圈大小为236 mm;菌株TB-5和XL-7均具有不同程度地产蛋白酶和铁载体能力;且在抑菌圈试验中均表现出对疫霉病菌、辣椒白绢病菌、烟草赤星病菌、白菜黑斑病菌、辣椒炭疽病菌和柑橘沙皮病菌有抗性;并在两菌株复配后将发酵液的抑菌圈直径扩大为27.0 mm,发酵上清液的抑菌圈直径也达24.5 mm。[结论] 通过对菌株TB-5、XL-7的胞外产酶能力以及抑菌谱测定包括复配能力探究,大大加强了传统的单一生防菌防效不稳定的问题,更具有生防潜力。
关键词 番茄青枯病;拮抗细菌;复配;产酶能力;抑菌谱
中图分类号 S436.412.1+5 文献标识码 A 文章编号 0517-6611(2025)06-0133-06
doi:10.3969/j.issn.0517-6611.2025.06.030
Screening and Identification of Antagonistic Bacteria Against Tomato Bacterial Wilt and Its Compounding Ability
TAN Ze-bao, HUAN Bao-lin, XIAO Qin et al
(College of Plant Protection, Hunan Agricultural University, Changsha,Hunan 410128)
Abstract [Objective] To screen out the biocontrol bacteria with broad spectrum resistance, and find the hybrid strains that have no resistance to each other and amplify the control effect of tomato bacterial wilt. [Method] Strains with antagonistic ability to Rella soleculosa were selected from the stem base of healthy tomato plants in Changsha, Hunan Province by using inhibition zone method and AGAR diffusion method, and their classification status was determined by morphological observation, 16S rRNA gene sequencing and phylogenetic analysis. More functions of biocontrol strains were explored by the determination of extracellular enzyme production capacity and bacteriostatic spectrum. [Result] From the 16 strains with antagonistic ability, two strains of biocontrol bacteria were identified as having high antagonistic ability and showed no difference in combination ability. The screened TB-5 was preliminatively identified as Bacillus mojavensis, and its inhibitory zone size against tomato bacterial wilt was 21.7 mm. XL-7 was identified as Bacillus siamensis, and its inhibitory zone size against tomato bacterial wilt was 23.6 mm. Strains TB-5 and XL-7 had different ability to produce protease and ferriferous carrier. They showed resistance to Phytophthora, Sclerotium rolfsii, Alternaria alternata, cabbage black spot, Colletotrichum capsici and Sarcophora citri. After the combination of the two strains, the diameter of the inhibition zone of the fermentation liquid was enlarged to 27.0 mm, and the diameter of the inhibition zone of the fermentation supernatant reached 24.5 mm. [Conclusion] Through the investigation of the extracellular enzyme production ability and antibacterial spectrum determination including the combination ability of strains TB-5 and XL-7, the problem of unstable control effect of traditional single biocontrol bacteria has been greatly strengthened, and the potential of biocontrol has been increased.
Key words Tomato bacterial wilt;Antagonistic bacteria;Compounding;Enzyme production ability;Bacteriostatic spectrum
番茄青枯病又名细菌性枯萎病,是茄科蔬菜的重要病害之一,主要危害番茄、茄子、辣椒、马铃薯等茄科蔬菜和生姜、花生、玉米等作物[1-6]。在番茄生产上的危害极其严重,目前尚无有效的防治方法能够绿色高效地防治番茄青枯病。
传统的防治手段包括选育抗性品种、化学防治、嫁接苗改良、土壤改良和代谢产物抗病[7],当前,化学药剂对病原菌的抑制效果较好,但对环境污染严重,长期大量使用会造成土壤肥力降低、酸碱变化、土壤板结[8]。黎起秦等[9]研究表明内生细菌B47对番茄青枯病的防效达79.79%;徐玲等[10]研究表明多粘类芽孢杆菌HY96-2对番茄青枯病的防效在69.7%~81.8%。但邱清华[11]研究表明两菌剂复配的防治效果明显优于单一生防菌剂;生物防治也因其单菌防效不稳定、无法成功定殖等缺点而受到一定的挑战。
在单一生防菌剂的基础上,陆续诞生了菌菌复配[12]、菌药复配[13]、菌肥复配[14]、菌-植物源提取物复配[15]等新型的高效生防模式,生防菌间复配的研究在单一生防菌的基础上提供了更高的稳定性,利用生防菌在土壤中占据病原菌的生态位,解析其生防机制后,更好更高效更大面积地发挥其控病、增产的能力。其中芽孢杆菌属包含多种植物病原物的拮抗菌,广泛地应用于植物病害防治[16]。
笔者从湖南长沙高桥镇一块高发青枯病的田块内挑取一颗健康的番茄植株茎基部进行拮抗细菌筛选,鉴定到9株对青枯雷尔氏菌有明显防效的菌株,并通过复配试验进一步筛选出菌株TB-5和XL-7,对两菌株进行形态学观察、16S rRNA基因测序、青枯菌拮抗能力测定、胞外产酶能力测定、抑菌谱能力测定和复配亲和性以及复配后的防效,验证复配菌株对番茄青枯病防效的提升,以期为番茄青枯病的生物防治提供更多的资源,为后续更复杂的发病田块提供治疗思路。
1 材料与方法
1.1 材料
从湖南省长沙市高桥镇青枯病高发病田的一株健康番茄植株茎基部分离的内生菌。
青枯雷尔氏菌RS04菌株来自实验室保存菌株,转接活化后以青枯病特异性引物pehA#3/6(5′-CAGCAGAACCCGCGCCTGATCCAG-3′/5′-ATCGGACTTGATGCGCAGGCCGTT-3′)进行 PCR 扩增鉴定,初步确定青枯雷尔氏菌RS04的致病性[17]。
LB培养基:氯化钠10 g,胰蛋白胨10 g,酵母提取物5 g,自然pH,121 ℃、20 min灭菌;LB固体培养基在此基础上加18~20 g琼脂。PDA培养基:200 g马铃薯切碎煮沸30 min,过滤后加入20 g葡萄糖,定容至1 L,自然pH,115 ℃、20 min灭菌;PDA固体培养基需在原PDA培养基的基础上加入15~20 g琼脂。
产蛋白酶培养基:酪蛋白20 g,琼脂粉18 g,超纯水1 L,自然pH,121 ℃、15 min灭菌备用;产磷酸酶培养基:葡萄糖10.00 g,磷酸钙5.00 g,硫酸铵0.50 g,酵母提取物0.50 g,氯化钠0.30 g,氯化钾0.30 g,硫酸镁0.30 g,硫酸亚铁0.03 g,硫酸锰0.03 g,琼脂粉15.00~20.00 g,121 ℃、15 min灭菌备用;产纤维素酶培养基:蛋白胨10.00 g,羧甲基纤维素钠10.00 g,氯化钠5.00 g,牛肉膏3.00 g,刚果红0.04 g,琼脂粉15.00~18.00 g,超纯水1 L,自然pH,121 ℃、15 min灭菌备用。
产铁载体培养基:铬天青S(CAS)0.060 g,十六烷基三甲基溴化铵(HDTMA)0.073 g,1 mmol/L六水氯化铁10 mL,0.1 mol/L磷酸盐缓冲液50 mL,琼脂粉9.000 g,超纯水定容至1 L,121 ℃、15 min灭菌备用[18]。
1.2 拮抗细菌的筛选与鉴定
1.2.1 细菌菌株的分离。
选取健康植株的茎基部,对其进行表面灭菌处理,将其置于无菌50 mL离心管中,加入灭菌的超纯水浸没样本,使用无菌镊子或夹子将植株的表土从茎基部分离,后将洗涤后的茎基部置于15 mL无菌离心管内,超声仪超声3次30 s;把处理好的茎基部样本置于研磨钵中,依次加入无菌水至5 mL,充分研磨收取上清液保存为原液。再通过梯度稀释涂布法,对原液进行分离涂布,28 ℃培养2 d后将所得到的单菌落划线纯化。
1.2.2 拮抗细菌的筛选。
以抑菌圈法进行菌株的初筛,将纯化后的各菌株转接后均以28 ℃、160 r/min摇床富集24 h,调整各菌液的OD600为1。将青枯菌RS04接种至LB培养基中,28 ℃、160 r/min培养24 h,调整菌液的OD600为1备用。将LB固体培养基置于微波炉加热溶解,待其冷却至45~50 ℃时,加入备用的RS04菌液,每200 mL培养基加入2 mL RS04菌液混匀后倒平板(培养皿直径90 mm),待培养皿彻底凝固后,使用牛津杯法对培养基进行打孔,再将对应的各菌株分别接种至孔内,28 ℃培养2~3 d观察反应,测定其有无抑菌圈产生。
1.2.3 拮抗细菌的鉴定。
形态学观察参照《伯杰细菌鉴定手册》[19]和《常见细菌系统鉴定手册》[20]判定,将筛选到的拮抗细菌在LB平板上划线和点,28 ℃、24 h培养,观察菌体颜色、大小以及形态特征。
以细菌通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和 1492R(5′-TACGGCTACCTTGTTACGACTT-3′)进行PCR扩增其16S rRNA基因;PCR 反应体系(25 μL):DNA模板 1 μL,上、下游引物(10 μmol/L)各1.0 μL,2×EasyTaq PCR SuperMix 12.5 μL,ddH2O 9.5 μL。16S rRNA 基因的 PCR 反应条件:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1.5 min,30 个循环;72 ℃ 10 min;将PCR产物交至湖南擎科生物科技有限公司进行一代测序鉴定,将所得序列提交至EZBioCloud(https:∥www.ezbiocloud.net/)网站进行序列比对,使用MEGA 5.1进行Neighbor-joining法构建系统发育树。