基于Taq-Man探针的多重qPCR检测DuCV•DEV•NGPV方法的建立与应用
作者: 杨孟豪 李丽湲 肖雅清 刘霞 刘永夏 孟凯
摘要 [目的]建立一种快速、特异的鸭圆环病毒(DuCV)、鸭肠炎病毒(DEV)、新型鹅细小病毒(NGPV)的多重荧光定量PCR方法。[方法]针对DuCV、DEV、NGPV的基因保守区域序列,设计合成3对特异性引物及3种荧光基团标记的Taq-Man探针。构建重组质粒标准品,优化反应条件。建立针对DuCV、DEV、NGPV的多重荧光定量PCR检测方法。[结果]该方法能同时鉴别检测DuCV、DEV、NGPV,并且与其他常见鸭病毒病不发生交叉反应。对DuCV、DEV、NGPV最低检出限均为2.5×101 copies/μL。该方法重复性好,组间和组内试验变异系数低于1.0%。用该方法检测150份临床样本,结果显示,DuCV、DEV、NGPV的阳性率分别为32.0%(48份)、23.3%(35份)和18.7%(28份),DuCV和DEV混合感染率为4.6%(7份),DuCV和NGPV混合感染率为8.6%(13份),总阳性率为87.3%(131份),未检出DEV和NGPV混合感染的结果。与常规PCR检测方法比较,阳性符合率为100%。[结论]该研究建立的基于Taq-Man探针的多重荧光定量PCR方法能够同时、快速、定量检测DuCV、DEV、NGPV。较普通PCR更敏感,实用性更强,有效避免了多次检测耗时长、费用高的问题,为DuCV、DEV、NGPV的监测和防控提供了有效可靠的检测技术。
关键词 鸭圆环病毒;鸭肠炎病毒;新型鹅细小病毒;Taq-Man探针;荧光定量PCR
中图分类号 S 851.34 文献标识码 A
文章编号 0517-6611(2024)22-0178-05
doi:10.3969/j.issn.0517-6611.2024.22.038
开放科学(资源服务)标识码(OSID):
Establishment and Application of Taq-Man Probe-based Multiplex qPCR Method for the Detection of DuCV,DEV and NGPV
YANG Meng-hao LI Li-yuan1,XIAO Ya-qing1,3 et al
(1.Poultry Research Institute of Shandong Academy of Agricultural Sciences,Jinan,Shandong 250100;2.College of Animal Science and Technology,Shandong Agricultural University,Tai’an,Shandong 271000;3.Hebei Agricultural University,Baoding,Hebei 071000)
Abstract [Objective]To establish a rapid and specific multiplex fluorescence quantitative PCR method for duck circovirus (DuCV),duck enteritis virus (DEV) and novel duck parvovirus (NGPV).[Method]Three pairs of specific primers and three fluorophore-labeled Taq-Man probes were designed and synthesized for the conserved region sequences of DuCV,DEV and NGPV.Recombinant plasmid standards were constructed,the reaction conditions were optimized,and multiplex quantitative PCR detection methods for DuCV,DEV and NGPV were established.[Result]The method could identify DuCV,DEV and NGPV at the same time,and did not cross-react with other common duck virus diseases.The minimum detection amount of DuCV,DEV and NGPV was 2.5×101 copies/μL.The method was reproducible,and the coefficient of variation between and within groups was less than 1.0%.A total of 150 clinical samples were tested with this method,the results showed that the positive rates of DuCV,DEV and NGPV were 32% (48 cases),23.3% (35 cases) and 18.7% (28 cases),respectively,the mixed infection rates of DuCV and DEV were 4.6% (7 cases),the mixed infection rate of DuCV and NGPV was 8.6% (13 cases),and the total positive rate was 87.3% (131 cases),and the results of mixed infection of DEV and NGPV were not detected.Compared with the conventional PCR detection method,the positive coincidence rate was 100%.[Conclusion]A multiplex real-time PCR method based on Taq-Man probes was established to detect DuCV,DEV,NGPV simultaneously,quickly and quantitatively.It is more sensitive and practical than ordinary PCR,which effectively avoids the problems of time-consuming and cost-effective multiple tests,and provides an effective and reliable detection technology for the monitoring and prevention of DuCV,DEV and NGPV.
Key words Duck circovirus (DuCV);Duck enteritis virus (DEV);Novel goose parvovirus (NGPV);Taq-Man probes;RT-PCR
中国的水禽养殖业在过去的几十年中不断发展,其规模也在不断扩大,目前中国的水禽养殖总量位居世界第一,但随着规模不断扩大,随之而来的就是疫病不断增多,水禽疫病不仅严重影响水禽饲养业的发展,同时也是水禽产业健康发展的桎梏,其中最大的障碍就是水禽病毒性疫病。
鸭圆环病毒(DuCV)首次被发现是在2003 年的德国[1] 。感染DuCV的鸭子表现出羽毛脱落、生长迟缓、体重降低和饲料转换率低等特征,严重影响了鸭养殖业[2] 。DuCV感染可导致机体产生免疫抑制,继发细菌性病原的二次感染,导致鸭的病死率升高[3] 。近年来,DuCV在我国鸭群中混合感染比例呈上升趋势[4-5] 。鸭肠炎病毒(DEV),也称为鸭瘟病毒,主要感染雁形目鸭科动物,造成鸭病毒性肠炎(DVE)[6] ,也称鸭瘟。1923 年荷兰首次报道了家鸭暴发鸭瘟,此后,全球大部分国家均对鸭病毒性肠炎的发生和流行有了报道[7-8],该病毒对鸭养殖业造成极大的影响。2014年11月以来,一种新型鸭源鹅细小病毒(NGPV)引发的“短喙-侏儒症”[9-10] 在我国樱桃谷鸭群中相继暴发。该病多发生于1月龄以内的肉鸭,大多数患鸭出栏时体重与健康鸭相比降低20%~30%,严重时患鸭仅为健康鸭体重的50%[11]。
目前,群发性或地方流行性水禽病毒性疫病尤为常见,且不仅出现单纯感染,更多以混合感染的形式发生,造成检测困难,治疗难度加大,从而导致发病状况和病死率更加严峻。有检测单位对2021年所接收的鸭病料检测结果中发现,病毒性病原检出率中,检出率较高的病毒包括鸭圆环病毒、鸭细小病毒、鸭肠炎病毒[12] 。以上3种病毒不但会造成宿主的单纯感染,也会出现混合感染,尤其是DuCV和DEV、DuCV和NGPV的混合感染普遍存在,混合感染相较于单纯感染不仅检测难度较高,而且对治疗也造成极大的困扰,对养殖业造成极大的损失。目前,有关DuCV、DEV和NGPV多重PCR 检测方法鲜见报道。
基于此,该试验建立了用于鉴别检测DuCV、DEV、NGPV的 Taq-Man 三重荧光定量PCR,以期为种鸭场的疫病净化提供技术。
1 材料与方法
1.1 试验材料
1.1.1 主要仪器。博恒基因扩增仪、Bio-Rad-CFX96荧光定量PCR仪器均购自杭州博日科技有限公司。
1.1.2 主要试剂。荧光定量PrimerMix酶,购自诺唯赞公司;质粒小提试剂盒、病毒DNA提取试剂盒,购自天根生物有限公司;pMD18-T载体,购自康润生物公司。
1.1.3 主要试材。鸭腺病毒3型(DadV-3)、H9亚型禽流感病毒(AIV-H9)、禽腺病毒4型(FadV-4)、呼肠孤病毒(DRV)、新城疫病毒(NDV)、鸭肝炎病毒(DHV)、鸭圆环病毒(DuCV)、鸭肠炎病毒(DEV)、新型鹅细小病毒(NGPV) 由山东省农业科学院家禽研究所保存,150份临床样本(肝、脾)采自山东各鸭养殖场临床疑似感染鸭。
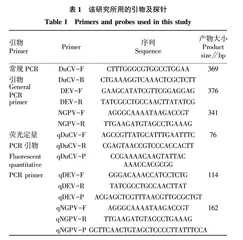
1.2 引物和探针
以GenBank收录的DuCV(登录号 MK814589.1)、DEV(登录号AF043730.1)、NGPV(登录号KY511124.1)基因序列为参考序列,针对DuCV的Rep基因、DEV的UL6基因、NGPV的VP1基因保守区域的序列分别设计一对常规PCR特异性引物和荧光定量PCR特异性引物及Taq-Man探针(表1),均由华大基因公司合成。
1.3 重组质粒标准品的构建
提取DuCV、DEV、NGPV的总DNA作为模板,分别使用表1中的引物。通过常规PCR仪扩增3个病毒的相应基因,扩增完成后,通过凝胶电泳观察条带是否正确,随后进行凝胶产物回收,连接至pMD18-T载体,构建病毒DNA的重组质粒标准品,分别命名为pDuCV-Rep、pDEV-UL6、pNGPV-VP1。测定3种重组质粒的浓度,计算出pDuCV-Rep、pDEV-UL6、pNGPV-VP1的拷贝数分别为2.83×1010、2.88×1010、3.13×1010 copies/μL,将pDuCV-Rep、pDEV-UL6、pNGPV-VP1稀释为2.5×109 copies/μL后,置于-20 ℃冰箱备用。
1.4 反应条件的优化
将3种重组质粒等比例稀释后选取2.5×107 copies/μL等比例混合后作为模板,与3对荧光定量PCR引物(qDuCV-F/R、qDEV-F/R、qNGPV-F/R)和3条Taq-Man探针(qDuCV-p、qDEV-p、qNGPV-p)在同一体系中进行扩增,采用方阵法,分别对循环数(35、40、45个)、引物浓度(终浓度分别为0.15、0.20、0.25、0.30、0.35、0.40、0.45 μmol/L)、退火温度(57、58、59、60 ℃)、探针浓度(0.05、0.10、0.15、0.20、0.25、0.30、0.35 μmol/L)进行梯度优化,得到最佳反应条件。