果生刺盘孢菌LFD-RPA可视化快速检测方法的建立
作者: 潘锐 徐会永 臧昊昱 谷春艳 齐永杰 杨雪 高正辉
摘要 建立针对果生刺盘孢菌(Colletotrichum fructicola)的快速、准确、简便的检测方法。根据果生刺盘孢菌的基因序列设计了特异性检测引物和探针,建立了重组酶聚合酶扩增与侧流层析试纸条(LFD-RPA)相结合的可视化快速检测果生刺盘孢菌的方法。该检测方法与其他病原菌无交叉反应,特异性强,且检测灵敏度达1 pg/μL。该检测方法无需 PCR 仪等复杂设备,在39 ℃恒温反应 12 min 即可完成检测过程,为果生刺盘孢菌的检验检测和早期预警提供了技术支撑。
关键词 果生刺盘孢菌;LFD-RPA;可视化快速检测
中图分类号 S 436.6 文献标识码 A 文章编号 0517-6611(2024)23-0136-04
doi:10.3969/j.issn.0517-6611.2024.23.028
The Visual Rapid Detection of Colletotrichum fructicola Based on LFD-RPA Assay
PAN Rui, XU Hui-yong, ZANG Hao-yu et al
(Institute of Plant Protection and Agro-products Safety, Anhui Academy of Agricultural Sciences, Hefei, Anhui 230001)
Abstract In order to establish a rapid, accurate and simple detection method of Colletotrichum fructicola. A visual rapid detection assay of C. fructicola was established by designing specific primers and probe according to the gene sequence of C. fructicola based on the combination recombinase polymerase amplification with lateral flow dipsticks (LFD-RPA). The detection method had strong specificity and high sensitivity (1 pg/μL), besides, there was no cross-reaction with other pathogens. This method could be applied without any expensive and complex equipments such as PCR apparatus, meanwhile, the temperature of reaction condition was 39 ℃ and detection time was less than 12 min. This study provided a quick and simple technology for the detection and early warning of Colletotrichum fructicola.
Key words Colletotrichum fructicola;LFD-RPA;Visual rapid detection
基金项目 农业农村部园艺作物种质创制与利用重点实验室(部省共建)项目;国家梨产业技术体系专项(CARS-28);安徽省农业科学院平台项目(2023YL015);安徽省果树产业技术体系(皖农科函〔2021〕711号);园艺作物种质资源创制与高效栽培安徽省重点实验室项目(皖科基地秘〔2023〕430号)。
作者简介 潘锐(1995—),女,安徽舒城人,助理研究员,硕士,从事植物病害防治研究。
*通信作者:杨雪,副研究员,硕士,从事植物病害检测及防治研究;高正辉,研究员,硕士,从事果树栽培与育种研究。
收稿日期 2023-12-28;修回日期 2024-02-27
果生刺盘孢菌(Colletotrichum fructicola)是一种常见的植物致病菌,可侵染咖啡属[1]、柑橘属[2-3]、梨属[4-7]、杧果属[8-9]、苹果属[10-12]等多种植物,且具有广泛的地域和物种多样性,在世界范围内均有危害报道[13-20]。梨炭疽病是由刺盘孢属真菌(Colletotrichum sp.)引起的,相关研究表明我国梨炭疽病的病原菌有12种,其中,果生刺盘孢菌为优势种[6]。虽然梨炭疽病的病原鉴定已经取得一些进展,但仅仅依赖形态学特征辨别、PCR分子检测以及单基因构建系统发育树等方法均易受到人为因素和环境条件的干扰。此外,上述鉴定方法需要专业技术人员和特殊仪器设备,检测程序烦琐、耗时长,不符合快速检测的要求。因此,建立快速简便的方法对由果生刺盘孢菌引起的病害进行检测和早期预警具有现实意义。
重组酶聚合酶扩增(recombinase polymerase amplification,RPA)技术是一种在恒温条件下进行短时(5~20 min)反应就可以扩增出靶标片段的核酸扩增技术[21],具有快速、灵敏、特异性高、操作简便等特点,已经成功应用于多种病原真菌、细菌、病毒和线虫等的检测[22-27]。同时,RPA技术与侧流层析试纸条(lateral flow dipsticks,LFD)相结合,可实现检测结果的可视化,大大提高了该检测技术的实用性并且扩大了适用范围[28-32],但该结合技术对果生刺盘孢菌的检测应用尚少见报道。
该研究根据已报道的果生刺盘孢菌的特异性基因序列设计引物,同时依据基因组聚类分析方法,建立了果生刺盘孢菌的RPA-LFD检测方法,该方法操作简单、快速灵敏、特异性强,便于基层人员对果生刺盘孢菌的早期快速检测,从而尽早对梨炭疽病采取防治措施,实现提高防控效果,减少损失的目的。
1 材料与方法
1.1 供试材料
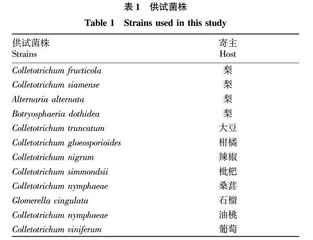
供试菌株(表1)均由安徽省农业科学院植物保护与农产品质量安全研究所提供并保存。砀山酥梨炭疽病病叶和病果采集于安徽省砀山县园艺场。侧流层析检测试纸条(彩虹型,JY0201)购于北京宝盈同汇生物技术有限公司。RPA检测试剂盒(WLB8201KIT)和植物基因组DNA提取试剂盒(DP305)分别由安普未来生物科技有限公司和天根生化科技(北京)有限公司提供。
1.2 方法
1.2.1 样品DNA制备。
根据真菌基因组DNA 提取试剂盒(Omega,D3390)操作说明书进行供试菌株的基因组DNA提取,并将该基因组DNA保存于-20 ℃冰箱备用。
1.2.2 引物设计和筛选。
通过系统比对筛选,将已报道的果生刺盘孢菌Unknown contig序列(NCBI Reference Sequence:NW_022474237.1:811738-813106)作为检测的目标基因,通过DNAMAN软件设计出特异性扩增引物Cf-F(5′-CGATTGTGAGTGAGCCCTAGTGGCGAGCCT-3′)、引物Cf-R(5′-CTTCGTATTTGTGGGAGTTGATTCGGGACT-3′)和探针Cf-Probe(5′-GAACTCTGTTACCATCAAGAAGTGCAGTCGC-TTCATCTGATATACTGCTT-3′),其中反向引物Cf-R的5′端修饰了一个生物素标记,探针Cf-Probe的5′端标记了异硫氰酸荧光素(FITC)基团,3′端的标记磷酸(PHO)基团,且5′端起第33位与第34位碱基中标记四氢呋喃(THF)基团。引物和探针均由通用生物(安徽)股份有限公司合成。
1.2.3 LFD-RPA检测体系及方法的建立。
使用RPA检测试剂盒,以果生刺盘孢菌的基因组DNA为模板,依照试剂盒说明书所述反应体系(总体积:50.0 μL),向RPA冻干酶中加入29.5 μL Buffer A、14.2 μL超纯水、10.0 μmol/L引物Cf-F 1.0 μL、10.0 μmol/L引物Cf-R 1.5 μL、10.0 μmol/L探针Cf-Probe 0.3 μL、1.0 μL DNA模板及2.5 μL Buffer B,充分振荡混匀,瞬时离心3 s,39 ℃恒温扩增12 min。反应结束后,将扩增产物稀释20倍,并将侧流层析检测试纸条置于稀释液中,室温放置1 min后观察反应结果,根据LFD试纸条的条带判断待测样品是否含有果生刺盘孢菌。
1.2.4 检测体系的特异性分析。
为验证该研究所设计的引物探针组合的检测特异性,以表1中所列的炭疽菌属的近缘种菌株的基因组DNA为模板,按照“1.2.3”中描述的LFD-RPA检测体系及方法进行检测,同时用等量无菌水替换模板DNA作为阴性对照。
1.2.5 检测体系的灵敏度分析。
为评估该研究中设计的引物探针组合的检测灵敏度,将果生刺盘孢菌的基因组DNA梯度稀释为1 ng/μL、100 pg/μL、10 pg/μL、1 pg/μL、100 fg/μL、10 fg/μL,按照“1.2.3”中描述的LFD-RPA检测体系及方法进行检测,同时用等量无菌水替换模板DNA作为阴性对照。
1.2.6 检测体系的适用性评价。
人工接种果生刺盘孢菌、梨黑斑病菌和梨轮纹病菌24 h后,将诱发的果实病害样品进行表面消毒处理并分别称取5 g的发病组织2份,一份使用植物基因组DNA提取试剂盒提取总核酸,一份置于无菌水中进行研磨,以研磨液为模板,利用该研究设计的引物及探针组合物,按照“1.2.3”中描述的LFD-RPA检测体系及方法进行检测,同时用等量的健康梨果实的DNA提取物和组织研磨液作为阴性对照。
1.2.7 检测体系的田间应用。
将田间采集的不同症状的梨病叶或病果样品,先用75%的乙醇进行表面消毒处理30 s,再用无菌水清洗3次,随后称取适量样品放入无菌水中进行研磨,以其研磨液为模板,利用该研究设计的引物及探针组合物,按照“1.2.3”中描述的LFD-RPA检测体系及方法进行检测,用果生刺盘孢菌的DNA作为阳性对照,等量无菌水替换模板DNA作为阴性对照。同时,对田间病样进行病原菌的分离鉴定,以对LFD-RPA检测体系及方法的准确性进行验证。
2 结果与分析
2.1 检测特异性验证
为验证该研究中所设计的引物和探针组合物及检测体系的特异性,从表1所示菌株中选取2株果生刺盘孢菌株和9种不同的炭疽病病原菌进行LFD-RPA检测,并根据LFD试纸条的条带判断待测样品是否含有果生刺盘孢菌。当LFD试纸条出现一条蓝色条带位于质控区内,一条红色条带位于检测区的情况,则结果为阳性,表明待测样品中含有果生刺盘孢菌;当LFD试纸条质控区内只出现一条蓝色条带,则结果为阴性,表明待测样品中不含有果生刺盘孢菌。
特异性检测结果如图1所示,只有2株果生刺盘孢菌的检测区出现红色目的条带,其他同属不同种的炭疽病菌与阴性对照均只出现蓝色的质控条带,说明该研究中,基于果生刺盘孢菌的基因序列设计的引物和探针具有种间特异性,可以用于区分果生刺盘孢菌与炭疽病菌的其他种,且检测结果肉眼可见,无需借助任何仪器,检测过程中操作简便、反应迅速便于基层检验检疫。
2.2 检测灵敏度验证