玉米品种真实性SSR分子检测体系优化
作者: 林显凤 罗友明 尚玥 赵长坤 龚辉 杨腾 白体坤 毛若涵 李仕伟 游宇
摘要 对南充市农业科学院提供的2份玉米品种,随机选用GB/T 39914—2021《主要农作物品种真实性和纯度SSR分子标记检测 玉米》中的12个SSR位点,利用琼脂糖凝胶电泳检测法、变性PAGE银染检测法和毛细管电泳分析法,分析了不同的扩增程序、仪器设备和反应体系等对PCR产物质量的影响。结果表明:60 ℃退火温度和novoprotein Taq DNA聚合酶有利于玉米品种真实性SSR标记的检测;2种PCR扩增仪对扩增结果并无较大区别。60 ℃-PCR1-E1,即60 ℃退火温度,PCR扩增仪1[TP-96A(F)],novoprotein Taq DNA聚合酶,毛细管电泳法相结合为最优组合,可作为四川品种真实性快速检测候选方法。
关键词 SSR标记;玉米;真实性;检测体系
中图分类号 S513 文献标识码 A 文章编号 0517-6611(2023)06-0093-07
doi:10.3969/j.issn.0517-6611.2023.06.023
Optimization of SSR Molecular Detection System for Maize Variety Authenticity
LIN Xian-feng1,2, LUO You-ming3, SHANG Yue2 et al
(1.Nanchong Academy of Agricultural Sciences, Nanchong, Sichuan 637000;2.Seed Quality Supervision and Inspection Station of Nanchong, Nanchong, Sichuan 637000;3.Seed Administrative Station of Nanchong, Nanchong, Sichuan 637000)
Abstract The 2 maize varieties provided by Nanchong Academy of Agricultural Sciences.12 SSR loci were selected from GB/T 39914-2021Variety Genuineness and Purity Testing of Main Crops with SSR Markers-Maize. Different methods including agarose gel electrophoresis, denaturing PAGE and capillary electrophoresis were used to analyze the effects of instruments, equipment and reaction system on the quality of PCR products. 60 ℃ annealing temperature and Novoprotein Taq DNA polymerase were more conducive to the detection of SSR markers for maize variety authenticity;There was no significant difference between the two PCR amplification instruments. 60 ℃-PCR1-E1, i.e. 60 ℃ annealing temperature, novoprotein Taq DNA polymerase and PCR1 amplification instrument [(TP-96A (F)] were the best combination, which could be used as candidate methods for variety authenticity detection in Northeast Sichuan.
Key words SSR marker;Maize;Authenticity;Detection system
玉米(Zea mays Linn.)是全球重要的粮食和饲料作物及工业生产原材料[1],在我国农业生产中起着巨大的影响作用[2]。随着我国玉米育种技术的更新换代,审定品种数量呈现“井喷式”增长,但遗传基础却越来越狭窄[3],以及玉米种子经营渠道多、乱、杂,各地普遍存在以假充真、以劣充优的现象,严重限制了农业生产的发展,使许多农户和经济组织遭受极大的经济损失[4-5]。玉米品种真实性和纯度检测的方法可以根据原理的不同,通过形态法、生理生化法、物理化学法、细胞学法、分子生物学法进行鉴定;还可以根据检验对象的不同分为种子测定法、植株测定法、幼苗测定法;还可以根据检验场所的不同分为田间小区种植鉴定和室内检验等[6]。国内一般采用田间小区种植鉴定和室内检验作为后控[6]。传统的品种真实性鉴定有形态鉴定法和田间小区种植鉴定法,这2种方法存在费工、费时、鉴定周期长、费用高等缺点,且这2种方法受环境和人为影响较大,鉴定者的观察经验也制约着鉴定的准确性[7]。用分子标记技术鉴别植物品种真实性[8-11],具有检测速度快,准确性高,重复性好,操作简单,且不易受季节和环境变化影响等特点[12],是一种快速、精准鉴定品种真实性的有效方法[13]。微卫星DNA(simple sequence repeats,SSR),是一种广泛分布于真核生物基因组中的串状简单重复序列[14],其重复单位为1~6个核苷酸,由10~20个重复单位串联组成[15]。SSR标记呈共显性遗传,可分辨出杂交种子的纯合体和杂合体,每个位点均有许多等位形式,多态性高,结果重演性和稳定性高,是目前较受欢迎的分子标记技术[16-19] 。
检测SSR PCR产物扩增结果的方法大致有以下5种:①琼脂糖凝胶电泳检测[20];②QIAGEN 琼脂糖毛细管电泳检测[21];③PAGE-放射自显影检测;④利用PAGE-银染法进行检测[22];⑤利用全自动核酸蛋白分析系统进行结果分析[23-24]。目前已有学者利用琼脂糖凝胶电泳SSR分子检测鉴定出玉米品种真实性和纯度检测最适宜的部位[25]。笔者选取①、④、⑤3个方法分析扩增程序、仪器设备和反应体系等因素对四川玉米品种真实性SSR分子测定结果质量的影响,筛选出适宜的试验条件以适应四川目前真实性室内分子检测工作开展的需要。
1 材料与方法
1.1 试验材料
供试玉米种子样品,由南充市农业科学院玉米研究所提供。共2个种子样品,分别为南N2142、南W816。
植物基因组DNA提取试剂盒(Aidlab),Taq DNA聚合酶:novoprotein(E1)、TIANGEN(E2)、四通道卡夹(Bioptic)。
智能人工气候箱(RTOP-1000Y);研磨仪(YMY200);PCR扩增仪1(TP-96A(F));PCR扩增仪2(BIO-RAD);微量紫外分光光度计(TP-L-1000);全自动凝胶成像系统(BIOTOP);聚丙烯酰胺凝胶电泳仪(BIO-RAD);荧光毛细管电泳设备(Bioptic-Qsep400)。
1.2 试验方法
1.2.1 DNA提取。
采取对玉米种子进行发芽试验,利用植物叶片直接提取的方法,每个试样取5~7粒种子的叶片混株样品,使用研磨仪进行研磨,用DNA提取试剂盒提取玉米全基因组DNA,方法详见试剂盒说明书。提取的DNA用微量紫外分光光度计检测DNA质量和浓度,并稀释到50 ng/μL。
1.2.2 PCR扩增。
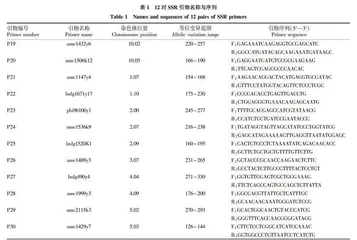
反应采用20 μL体系,2×Taq PCR Mix 10 μL,10 μmol/L上、下游引物各1 μL,DNA 1 μL,ddH2O 7 μL。引物使用GB/T 39914—2021《主要农作物品种真实性和纯度SSR分子标记检测 玉米》中的12对引物(表1)进行PCR扩增[26]。PCR反应程序:94 ℃预变性3 min;94 ℃变性30 s,53/60 ℃退火30 s,72 ℃延伸1 min,共30个循环;72 ℃延伸7 min,4 ℃保存。
1.2.3 琼脂糖凝胶电泳检测。
扩增产物需在PCR仪上执行变性程序:95 ℃变性5 min,4 ℃冷却10 min以上。采用2.0%琼脂糖凝胶进行电泳,点样时同一引物的2个样品相邻,稳压稳流状态电泳后用全自动凝胶成像系统进行照相读带。
1.2.4 变性聚丙烯酰胺凝胶电泳检测。
采用GB/T 39914—2021《主要农作物品种真实性和纯度SSR分子标记检测 玉米》中的检测方法。扩增产物自带染料,无须加入Lading Buffer。扩增产物需在PCR仪上执行变性程序:95 ℃变性5 min,4 ℃冷却10 min以上。采用4.5% PAGE进行灌胶,点样时同一引物的2个样品相邻,90 W电泳80 min后用银染法显带并观察结果。银染法显带步骤:固定—漂洗—染色—漂洗—显影—定影—漂洗。
固定,10%HAc,1次,3 min;漂洗,ddH2O,1次,<10 s; 染色,0.2%AgNO3,1次5 min;漂洗,双蒸水,1次,<10 s;
显影,30 g NaOH+5 mL HCHO定容至1 000 mL ddH2O中,摇床上轻轻晃动至纹带出现;定影,10%HAc定影,5 min;漂洗,ddH2O,1次,<10 s。
1.2.5 毛细管电泳检测。
将样品在PCR仪上95 ℃变性5 min取出,冷却10 min以上。用Qsep400荧光毛细管电泳设备进行电泳检测。电泳步骤:联机与通气检查—放入缓冲液和Marker—放入样品并复位—置入卡夹—卡夹锁定与校准—程序设定,程序设定好后点击Run,开始电泳分离,可点击Real time实时监测电泳过程。结果用Q-Analyzer for Qsep400软件进行分析。
1.3 试验设计
采用53、60 ℃ 2个退火温度;2种不同来源的Taq DNA聚合酶;2台不同企业不同年度购买的PCR扩增仪;3种不同的电泳方法。为便于图片标记和数据处理,分别对试验数据进行编号(表2),并根据表3的试验条件进行试验。
2 结果与分析
2.1 DNA模板质量检测
用植物基因组DNA提取试剂盒(Aidlab)提取的DNA模板,采用微量紫外分光光度计(TP-L-1000)进行检测。检测结果显示(表4),所提取的DNA模板质量较高,能够满足试验处理的质量要求。每个样品稀释至50 ng/μL备用。
2.2 琼脂糖凝胶电泳下不同处理对PCR产物质量的影响
采用琼脂糖凝胶电泳的方法分析了扩增程序中不同退火温度、不同PCR扩增仪和不同Taq DNA聚合酶对玉米品种真实性SSR标记扩增产物质量的影响。对比PCR产物电泳谱带的清晰度和干净度可知,53 ℃退火温度条件下,电泳谱带拖带明显,特异性较低,非特异性产物较多,杂质多;60 ℃退火温度条件下,条带特异性高,杂质少,条带和背景较53 ℃退火温度图谱清晰、干净。利用novoprotein(E1)和天根(E2)Taq DNA聚合酶得到的PCR产物电泳条带特异性均较高,目标条带比较清晰、杂质少、背景较干净。但天根Taq DNA聚合酶未能扩增出IbA甲、IIbA甲、IbB甲、IIbB甲中P25目的条带。使用TP-96A(F)和BIO-RAD PCR仪进行扩增,对比条带特性、背景清晰度可知,不同品牌仪器对结果的影响并不明显(图1)。因此,采用琼脂糖凝胶电泳方法,得到结果为60 ℃退火温度和novoprotein Taq DNA聚合酶较有利于开展玉米品种真实性SSR标记的检测。