大豆根际对羟基苯甲酸降解菌分离及其促生功能研究
作者: 王丹丹 孙丽 于宏 崔世宇 庞诗琪 解志红
摘要 从大豆根际土壤中利用对羟基苯甲酸为唯一碳源,筛选获得6株具有对羟基苯甲酸降解及利用能力的根际促生菌,其降解能力强且降解底物多样。通过16S rRNA基因测序,确定根际促生菌菌株的分类地位,其中PA17为假单胞菌属(Pseudomonas),具有较好的应用前景。促生试验表明,PA17具有吲哚乙酸合成能力、固氮能力,同时具有解有机磷及无机磷的能力。发芽试验证明,PA17可促进大豆种子的萌发,并可显著促进大豆胚根的发育;盆栽试验表明PA17也可明显促进大豆幼苗的生长。该研究为生物方法缓解连作障碍提供高效降解菌株及理论依据。
关键词 对羟基苯甲酸;降解菌;连作障碍;根际促生菌
中图分类号 S182 文献标识码 A
文章编号 0517-6611(2023)20-0011-04
doi:10.3969/j.issn.0517-6611.2023.20.003
Isolation of p-hydroxybenzoic Acid Degrading Bacteria from Soybean Rhizosphere and Their Growth Promoting Functions
WANG Dan-dan,SUN Li,YU Hong et al
(College of Resources and Environment,Shandong Agricultural University,Tai’an,Shandong 271000)
Abstract Six rhizosphere promoting bacteria with the ability to degrade and utilize p-hydroxybenzoic acid were screened from soybean rhizosphere soil using p-hydroxybenzoic acid as the sole carbon source.These bacteria had strong degradation ability and diverse degradation substrates.By sequencing the 16S rRNA gene,the taxonomic status of rhizosphere growth promoting bacteria strains was determined,among which PA17 belongs to the genus Pseudomonas,which had good application prospects.The result of growth-promoting experiments indicated that PA17 showed the ability of IAA-producing,nitrogen-fixing and phosphate solubilization.Germination experiment and pot experiment showed that PA17 could significantly promote soybean seed germination,radicle and seeding growth.This study provides efficient degradation strains and theoretical basis for biological methods to alleviate continuous cropping obstacles.
Key words p-hydroxybenzoic acid;Degrading bacteria;Continuous cropping obstacle;Plant growth-promoting rhizobacteria
大豆是我国主要的油料作物之一,也是重要的粮食作物,但随着大豆连续种植年限的增加及不合理轮作制度,使大豆连作障碍问题成为制约我国大豆产业的重要因子[1-2],如何有效缓解大豆连作障碍,提高大豆的产量与品质,成为我国大豆产业急需解决的问题。
连作障碍会降低大豆对营养元素的吸收能力,影响大豆各个时期的正常生长,同时还会引起植物病害加重,最终降低大豆的产量和品质[3-5]。大豆连作障碍是植物与土壤2个系统多个因素综合作用引起的,其中一个重要原因是土壤中自毒物质的积累[6-7]。自毒作用是化感作用的一种特殊形式,即作物分泌的化感物质在土壤中积累,会抑制同茬或下茬的同种或同科作物的生长发育[8]。酚酸类化感物质常被认为是根系分泌物中主要的自毒化感物质[9-10],大豆根系分泌物中常见的酚酸类自毒化感物质有对羟基苯甲酸、香草酸等[9,11-12],其中对羟基苯甲酸(p-Hydroxybenzoic acid,PHBA)能影响根系细胞线粒体正常功能,导致活性氧积累,从而影响植物根系的正常生长[13-14],也会造成植物无法正常利用光合作用吸收的能量,影响植株正常生长[15];对羟基苯甲酸还会损伤根系细胞,破坏根系的完整性,使土传病原菌更易从植物根系入侵,引起植物病害蔓延[16-17];此外,对羟基苯甲酸的积累导致连作土壤理化性质恶化,不利于作物对养分的利用[18-19]。
土壤中自毒化感物质酚酸的积累是导致连作障碍的一个重要原因,有效实现酚酸安全降解进而有效缓解连作障碍是大豆产业的重要发展方向。根际促生菌(plant growth promoting rhizobacteria,PGPR)是指附着于根际土壤颗粒中,对植物健康生长发挥着重要作用的一类根际微生物[20],根际促生菌具有降解自毒化感物质、抑制有害植物病原菌生长、促进植物生长、增加土壤微生物群落中有益微生物数量、对环境无污染的特点,在连作障碍治理中应用广泛[19,21]。在大豆连作障碍土壤中接种有酚酸降解功能的根际促生菌,利用微生物分解连作土壤中累积的自毒化感物质,有望成为一项健康有效的治理措施。目前,利用选择培养基从自然环境中已筛选获得多种具有对羟基苯甲酸降解功能的根际促生菌,包括假单胞菌属(Pseudomonas sp.) [19]、不动杆菌属(Acinetobacter sp.) [21]、克雷伯氏菌属(Klebsiella sp.) [22]等,这些微生物可以高效降解对羟基苯甲酸且降解底物多样,在缓解连作障碍中具有较好的实际应用价值[23]。
利用根际促生菌治理大豆连作障碍可持续性强且对生态环境友好,而寻找有效的可以使用的多功能根际促生菌是生物治理实施的前提,因此,该研究从连作5年的大豆根际土壤中以对羟基苯甲酸为唯一碳源筛选降解菌株,并测定其对大豆发芽及幼苗生长的影响,为生物治理大豆连作障碍提供可利用根际促生菌菌株。
1 材料与方法
1.1 供试土壤
样品取自吉林省延边朝鲜族自治州5年连续大豆种植地,将大豆植株根部挖出,抖落大块附着土,根系1 cm内的根际土收集后置于4 ℃保存运输。
1.2 培养基、主要试剂和仪器
LB培养基(蛋白胨 10 g/L,酵母粉 5 g/L,NaCl 10 g/L)、无机盐培养基(KH2PO4 2 g/L,Na2HPO4 1.3 g/L,(NH4)2SO4 2 g/L,NaCl 5 g/L,葡萄糖1 g/L)。基因组提取试剂盒,购自Axygen生物技术(杭州)有限公司;16S扩增引物,购自TaKaRa生物技术(大连)有限公司;高保真聚合酶Primes STAR HS DNA polymerase,购自TaKaRa生物技术(大连)有限公司。
1.3 对羟基苯甲酸高效降解菌的分离
从连续种植5年的大豆耕地中选取长势较好的植株,采集根际土壤,按1%质量体积比将土壤接种于1 g/L对羟基苯甲酸的无机盐培养基中,35 ℃摇床180 r/min,使能够降解对羟基苯甲酸的菌株得到富集。土壤悬液在摇床中培养10 d后稀释涂布于LB培养基上,35 ℃培养12 h。挑取单菌落划线于LB固体培养基上,35 ℃培养12 h后观察菌落特征,若培养特征完全一致则为同一种菌,否则需多次划线反复纯化直至菌落特征一致。
1.4 高效降解菌株筛选及其耐受性测定
为获得高效降解菌株,将无机盐培养基中对羟基苯甲酸浓度提高至5 g/L。将-80 ℃甘油管菌种于LB固体培养基上活化,35 ℃培养12 h,挑取单菌落接种于LB液体培养基中,35 ℃、180 r/min培养12 h即为种子液。种子液按1%的接种量转接至新LB液体培养基中,35 ℃、180 r/min振荡培养至OD600=0.5,取1 mL菌液加至49 mL无机盐培养液中,35 ℃、180 r/min培养观察菌株是否可以生长。
将筛选到的高效降解菌株再接种到对羟基苯甲酸浓度为10、15、20、25、30 g/L无机盐培养基中,35 ℃、180 r/min培养观察菌株生长情况。
1.5 自毒物质降解率测定
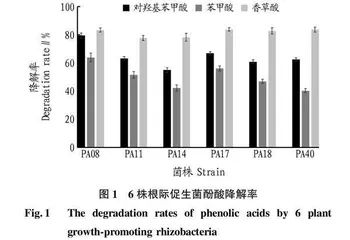
高效降解菌株菌液(培养方法见“1.3”)接种至49 mL无机盐培养液中(对照加入1 mL无菌水),培养液中以不同酚酸自毒物质为唯一碳源,浓度为5 g/L,35 ℃摇床培养72 h,8 000 r/min离心10 min,采用紫外可见分光光度法,取上清液测定对应自毒物质的最大吸收峰波长的吸光度,并计算降解率。各物质的测定吸收波长分别为对羟基苯甲酸246 nm、苯甲酸230 nm、香草酸250 nm。降解率=(对照吸光度-处理后样品吸光度)/对照吸光度×100%。
1.6 根际促生菌菌株鉴定
提取根际促生菌基因组DNA,扩增16S rRNA序列片段,扩增引物为27F(AGAGTTTGATCMTGGCTCAG)、1429R(TACGGYTACCTTGTTACGACTT)。
电泳检测产物片段后送至测序公司测序,16S rRNA序列片段在EZBioCloud网站上进行序列同源性比对分析。
1.7 根际促生菌促生能力测定
固氮能力测定采用Ashby无氮固体培养基,将目标根际促生菌接种于Ashby无氮固体培养基上,35 ℃培养7 d,记录菌株的长势。
解磷能力测定采用无机磷固体培养基和卵黄固体培养基,将目标根际促生菌分别接种于无机磷固体培养基和卵黄固体培养基上,35 ℃培养3 d,观察是否有溶磷圈出现。
IAA合生能力测定采用Salkowski法,将目标根际促生菌接种于含L-色氨酸(200 mg/L)的LB液体培养基中,35 ℃、170 r/min摇床培养4 d,菌液于4 ℃、8 000 r/min条件下离心10 min,取上清液于酶标板中,加入等体积Salkowski比色液,黑暗条件下静置反应30 min后,迅速于530 nm下测定吸光度。
1.8 种子发芽试验
根际促生菌促进种子萌发试验以大豆为试验对象,大豆浸泡于70%乙醇10 min后用无菌水清洗3遍完成消毒。CK为空白对照,消毒后的大豆种子置于含无菌水的培养皿中;处理T1为消毒后的种子置于根际促生菌菌液中(细菌在OD600为0.5时离心收集菌体,菌体用无菌水清洗3次后重悬,接种量为1%)。每个处理10粒种子,设置5次重复。
1.9 盆栽试验
盆栽土壤取自吉林省延吉市5年连续大豆种植地块,121 ℃灭菌20 min,重复灭菌2次后自然风干,土壤、蛭石、珍珠岩按3∶1∶1体积比混匀,拌入无菌MS营养液到达湿润状态,分装至盆栽盆中,每杯约200 g。大豆种子70%乙醇浸泡10 min,无菌水清洗3遍后在无菌水中浸泡12 h,放入培养基质中。CK为空白对照,消毒后的大豆种子置于固体基质中;处理T1则加入根际促生菌菌液,将活化好的菌株菌液统一调节 OD600 为0.5,每杯加入500 μL菌液,每组重复5次。培养30 d后小心从培养基质中取出完整的大豆植株,将根部冲洗干净后测量植株的根长、苗高、鲜重、干重。
1.10 数据处理及分析 利用Microsoft Excel和Origin 9.1软件进行数据分析及图表制作。
2 结果与分析
2.1 对羟基苯甲酸高效降解菌的筛选