白色霞水母刺细胞毒素对小鼠的毒性作用研究
作者: 冯金华 于华华 李丽娜 姜帅 郑文静
摘要 通过研究白色霞水母刺细胞毒素(CNV)对小鼠的毒性作用,探索CNV的毒性特征。结果发现,CNV致小鼠出现多种中毒反应、多组织器官超微结构发生形态学改变、甚至死亡,小鼠皮内注射LD50为33.64 mg/kg。注射33.64 mg/kg CNV 4 h后,小鼠皮肤坏死、肺细胞水肿样改变、肾损伤严重,肾小管细胞趋向坏死、心脏和肝脏超微结构变化小。该研究结果可为白色霞水母蜇伤的救治及蜇伤药物的研制提供参考依据。
关键词 白色霞水母;毒素;致死活性;皮肤坏死;超微结构
中图分类号 R 282.77文献标识码 A文章编号 0517-6611(2022)14-0076-05
doi:10.3969/j.issn.0517-6611.2022.14.019
开放科学(资源服务)标识码(OSID):
Study on the Toxicity of the Nematocyst Venom from Cyanea nozakii Kishinouye on Mice
FENG Jin-hua1, YU Hua-hua2, LI Li-na1 et al
(1.Ocean College, Hebei Agricultural University, Qinhuangdao, Hebei 066003;2.Institute of Oceanology, Chinese Academy of Sciences, Qingdao,Shandong 266071)
Abstract The toxicity effects induced by nematocyst venom of Cyanea nozakii (CNV) on mice were studied, and the toxic characteristics of CNV was explored. The results showed that CNV induced multiple toxic reactions, morphological changes in the ultrastructure of multiple tissues and organs,and even death in mice. LD50 of mice for intradermal injection was 33.64 mg/kg. After 33.64 mg/kg CNV was injected 4 h, skin necrosis, edema-like changes of lung cells, severe kidney injury, tubular cell necrosis, and small changes of ultrastructure of heart and liver were observed. The research results could provide reference basis for the treatment of jellyfish stings and the development of stinging drugs.
Key words Cyanea nozakii Kishinouye;Venom;Lethal activity;Skin necrosis;Ultrastructure
水母是刺胞动物在浮游生物中的代表,广泛分布于温带、亚热带及热带海域。刺细胞是刺胞动物特有的细胞器,是刺胞动物赖以捕食和御敌的武器,当刺细胞受到物理、化学、生物等因素的刺激时可释放出毒液[1]。海洋中的水母有10 000余种,其中100余种对人类有毒性,当人类与其接触时刺细胞中的毒液成分可经管状的刺丝注入皮内,引起蜇伤。
不同水母所含刺细胞的种类各异[2],其释放的毒液成分及其活性特征各不相同[3-4]。不同水母造成的蜇伤症状复杂多样[5]。目前已报道的水母蜇伤症状最常见的是局部炎症反应,严重的还包括休克、脏器衰竭,甚至死亡[6-7]。随着全球水母暴发,水母蜇伤已经成为危害严重的海洋生物伤害之一[8]。
目前,国内外对水母蜇伤的研究着重于临床症状观察以及治疗、护理等方面[7,9]。由于水母毒素中致病性物质及其致病机理还不明确,水母蜇伤后的急救治疗缺乏理论依据。
白色霞水母是典型的有害水母种类,既无经济价值,又对接触者有较大的蜇伤毒性。自20世纪末起,东海北部至黄海、渤海水域连续发生白色霞水母暴发现象,且有愈演愈烈之势。被白色霞水母蜇伤后,往往引起严重的皮肤损伤,受伤皮肤出现红斑、瘀斑、出血等荨麻疹斑块;同时,还可能伴有呼吸道症状和全身症状,比如剧烈咳嗽、呼吸困难,甚至丧失意识[10-11]。研究表明,白色霞水母刺细胞内毒素具有溶血活性、神经毒性、金属蛋白酶和磷脂酶A2活性等[4,12-14]。目前,虽然对白色霞水母毒素的毒性成分越来越了解,但是白色霞水母毒素对哺乳动物的毒理特性还未见报道。笔者研究了白色霞水母刺细胞毒素对小鼠的毒性作用,检测刺细胞毒素对小鼠的致死毒性、对皮肤和内脏组织的病理损害,探索白色霞水母毒素蛰伤的中毒机理,旨在为白色霞水母蜇伤治疗和蜇伤特效药物的研制提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试验材料。白色霞水母( Cyanea nozakii Kishinouye)于2010年8月采自青岛第一海水浴场附近,由中国科学院海洋研究所高尚武教授进行品种鉴定。触手从水母伞盖处人工切除后,立即于-80 ℃下冷冻保存,备用。
1.1.2 主要仪器。GL-20B-Ⅱ高速冷冻离心机,由上海安亭科学仪器厂生产;3110BXEUR美国Mini Beadbeater珠磨机,由上海上碧实验仪器有限公司生产;PMS-100解剖镜,由浙江托普仪器有限公司生产;XSZ-G光学显微镜,由重庆光学仪器厂生产;722S紫外可见分光光度计、FD-5N真空冷冻干燥仪,由上海精密科学仪器有限公司生产;H-7000透射式电镜,由日立高新技术公司生产;HH-2恒温水浴锅,由常州国华电器有限公司生产;902-ULTS超低温冰箱,由美国Thermo公司生产。
1.1.3 主要试剂。硫酸钠(AR)、三羟甲基氨基甲烷(AR)、磷酸氢二钠(AR)、磷酸二氢钠(AR),由国药集团化学试剂有限公司生产;牛血清白蛋白BSA(AR)由北京索莱宝科技有限公司生产;戊二醛(AR)由天津欧博凯化工有限公司生产;盐酸(AR)由上海环发化工有限公司生产。
1.1.4 实验动物。SPF级KM(昆明)小鼠,平均体重(20±2)g,购于青岛市药品检验所。
1.2 方法
1.2.1 刺细胞毒素的制备。
1.2.1.1 刺细胞的制备。冷冻的白色霞水母触手用无菌海水4 ℃下浸泡(体积比1∶4),每24 h换1次新鲜海水(保留沉淀,在此期间可用玻璃棒轻轻搅拌几次)。4 d后,用54 μm 孔径的滤筛过滤,去除未溶解的触手组织和较大的组织碎片,滤液离心并收集沉淀。沉淀用0.9% NaCl溶液悬浮,13 000 r/min 离心15 min后,去掉上清液;通过显微镜观察,用小勺轻轻将沉淀上层破碎的刺细胞和小的组织碎片去除,底层的沉淀重新用0.9% NaCl溶液悬浮,13 000 r/min离心;显微镜观察发现沉淀中刺细胞含量在90%以上时,将沉淀收集、冷冻干燥后即得水母刺细胞样品,-80 ℃下保存,备用。
1.2.1.2 刺细胞毒素的提取。使用Mini Beadbeater珠磨机破碎刺细胞;破碎管中加入1/2体积直径0.5 mm的玻璃珠,再加入冷冻干燥的刺细胞和Tris-HCl缓冲液(50 mmol/L,pH 7.8),4 600 r/min转速下振荡破碎,每次1 min,共4~5次,每破碎1次冰水预冷1 min。将破碎液13 000 r/min下冷冻离心15 min,所得上清液即为白色霞水母刺细胞毒素(CNV),-80 ℃下保存备用。
1.2.1.3 蛋白质含量的测定。以牛血清白蛋白(BSA)作为标准,采用Bradford法[15]测定CNV中总蛋白的含量。
1.2.2 CNV对小鼠的致死毒性检测。用昆明种清洁级小鼠,设置5个试验组(A、B、C、D、E),每组6只,雌雄各半,皮内注射不同浓度的CNV溶液200 μL;对照组6只小鼠,注射200 μL Tris-HCl缓冲液(50 mmol/L,pH 7.8)。观察并记录各组小鼠的表现,记录死亡时间并统计24 h后的死亡数,计算LD50。
1.2.3 CNV致皮肤坏死作用观察。清洁级昆明小鼠10只,对照组和试验组各5只。试验前1 d,用8%硫化钠将小鼠背部脱毛。在备毛处,采用皮内注射的方法,试验组注射1个LD50剂量的毒素样品200 μL,对照组注射相同体积的Tris-HCl缓冲液(50 mmol/L,pH 7.8),观察注射毒素1 h、1 d、2 d 后小鼠皮肤的变化。
1.2.4 CNV致小鼠组织病理变化的透射电镜观察。试验前1 d,将小鼠背部的被毛先用剪刀剪去,尽量剪短,但不要剪破皮肤。然后,用温水将该部位润湿,再用纱布包扎棉球的小棒蘸脱毛剂(8%Na2S溶液),在需脱毛部位涂1层,2~3 min后用温水洗去该部位脱下的毛,自然晾干,备用。
将小鼠完全随机分为试验组和对照组2组,每组5只。试验组在小鼠背部备皮处皮内注射1个LD50剂量的毒素样品200 μL;对照组注射相同体积的Tris-HCl缓冲液(50 mmol/L,pH 7.8)。
配制含5%戊二醛的PBS缓冲液(150 mmol/L,pH 7.3~74)及生理盐水,置于4 ℃下预冷,作为固定液。
注射毒素样品4 h后,立即将小鼠解剖,取对照组和试验组注射部位皮肤、心、肺、肝、肾。取材时,先在解剖盘上滴2滴固定液,在5%固定液中迅速用双面刀片切取小块样品放入固定液中,1 h内迅速将小块样品切成体积0.5 mm3的小块,放入盛有固定液的样品瓶(置于4 ℃冰箱中预冷)。由于肺组织内部有气体无法彻底排放,导致肺组织悬浮于固定液表面,固定液不能及时渗透进组织内部,从而导致大部分组织固定不良,所以取纱布条压于肺组织小块上,使组织沉底,全部浸泡在固定液中保存。应用解剖镜,将心脏组织小块沿肺纤维方向修成长条状。为了防止采集过程中细胞快速死亡自溶,环境温度应保持在0~10 ℃。将上述固定好的样品用1%OsO4作后固定,经乙醇梯度脱水、国产618环氧树脂包埋、超薄切片机切片,用醋酸双氧钠和柠檬酸铅染色,最后使用日立H-7000型透射电镜进行观察。
2 结果与分析
2.1 小鼠CNV中毒后的表现
小鼠皮内注射毒素后开始观察,发现小鼠出现静伏少动、竖毛、蜷缩、后肢伸展、松弛、走路蹒跚、感觉稍迟钝、行动缓慢,睁眼困难,食欲减退,严重者出现全身抽搐、呼吸急促、死亡等中毒症状。
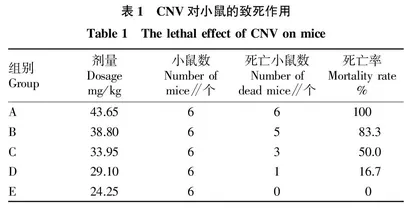
如表1所示,CNV致小鼠死亡率呈现出明显的剂量依赖性。当毒素剂量为43.65 mg/kg时可致小鼠快速死亡,小鼠出现全身抽搐、呼吸急促,1~4 h内死亡4只,24 h后死亡6只;当毒素剂量为38.80 mg/kg时,小鼠4 h内死亡2只,另有3只出现静伏少动、不食、呼吸急促、睁眼困难等症状,24 h后死亡5只。随着毒素剂量的降低,注射毒素后小鼠越活泼,症状越不明显,存活时间越长。
经观察发现,全部动物均表现为呼吸先完全停止,待肉眼观察到小鼠呼吸停止后再打开胸腔,暴露出心脏,心脏仍维持跳动2~10 min。
参照熊浩明等[16]的方法,按表1数据计算得出,CNV致小鼠死亡的LD50为33.64 mg/kg。
2.2 CNV致皮肤坏死作用
如图1所示,试验组小鼠皮内注射33.64 mg/kg的毒素样品200 μL,1 h后注射部位开始隐现红色区域,随着时间的推移,皮肤损伤症状逐渐明显;1 d后,注射部位皮肤中央凹陷,出现暗红色斑块,周围出现小鼠抓伤的痕迹;随着时间的延长,斑块继续向外沿扩展,颜色变为紫褐色,表面皮肤变硬;2 d后,注射部位形成焦痂,呈坏死症状。随着时间的延长,深褐色焦痂继续增厚甚至溃烂。对照组小鼠皮肤没有观察到明显病理变化。