猪瘟病毒实时荧光重组酶聚合酶扩增检测方法的建立及应用
作者: 杨俊 聂福平 王昱 史梅梅 谢晓倩 王国民 李贤良 吴蕊 张欢 唐昌杰 李应国
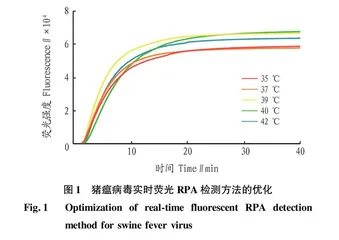
摘要 [目的]建立猪瘟病毒(CSFV)快速、灵敏的检测方法。[方法]选择CSFV基因组中保守的5′端非编码区(NTR)作为研究对象,根据重组酶聚合酶扩增(RPA)原理,设计特异性RPA引物和exo探针,并对反应温度和时间进行优化,建立检测猪瘟病毒的实时荧光RPA方法。[结果]该研究建立的方法能在39 ℃恒温条件下30 min内得到检测结果,实现了快速检测CSFV的目的。该方法仅对CSFV的核酸有扩增反应,而对猪传染性胃肠炎病毒(TGEV)、猪胸膜肺炎放线杆菌(APP)、副猪嗜血杆菌(HPS)、猪肺炎支原体(Mhp)、猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病毒2型(PCV-2)、猪水疱病病毒(SVDV)和猪细小病毒(PPV)8种常见猪病病原的检测结果均为阴性,表现出良好的特异性,对含有CSFV目的片段的重组质粒的最低检测限为8.3×102 copies/μL。同时使用新建立的CSFV实时荧光RPA检测方法和国家标准(GB/T 16551—2020)中的实时荧光RT-PCR对采集自重庆某养猪场的33份临床样本进行CSFV核酸检测,以验证CSFV的实用性,结果显示,2种方法检出的阴、阳性样本完全一致。[结论]该研究建立的CSFV实时荧光RPA方法反应条件温和、核酸扩增迅速、检测结果特异、灵敏,为CSF的诊断提供了新的选择。
关键词 猪瘟病毒;核酸检测;等温扩增;重组酶聚合酶扩增;聚合酶链反应
中图分类号 S 852.65+1 文献标识码 A
文章编号 0517-6611(2022)20-0166-04
doi:10.3969/j.issn.0517-6611.2022.20.043
Development and Application of Real-Time RPA Method for Detection of Classical Swine Fever Virus
YANG Jun,NIE Fu-ping,WANG Yu et al
(Chongqing Customs Technology Center,Chongqing 400020)
Abstract [Objective]To establish a rapid and sensitive detection method for Classical Swine Fever Virus (CSFV).[Method]The 5′ conserved non coding region (NTR) in CSFV genome was selected as the research object.According to the principle of recombinase polymerase amplification (RPA),specific RPA primers and exo probe were designed.The reaction temperature and time were optimized,and then a real-time fluorescent RPA method for the detection of CSFV was established.[Result]The method established in this study could obtain the detection results within 30 minutes under the constant temperature of 39 ℃,and realize the purpose of rapid detection of CSFV.The method only amplified the nucleic acid of CSFV,but was not suitable for transmissible gastroenteritis virus (TGEV),Actinobacillus pleuropneumoniae (APP),Haemophilus parasuis (HPS),Mycoplasma hyopneumoniae (Mhp),porcine reproductive and respiratory syndrome virus (PRRSV),porcine circovirus type 2 (PCV-2),porcine vesicular disease virus (SVDV) and porcine parvovirus (PPV) 8 common swine pathogens were all negative,and showed good specificity,and the minimum detection limit for the recombinant plasmid containing the CSFV target fragment was 8.3×102 copies/μL.The developed CSFV real-time fluorescent RPA method and the real-time fluorescent RT-PCR in the national standard (GB/T 16551-2020) were used at the same time to detect CSFV nucleic acid in 33 clinical samples collected from a pig farm in Chongqing to verify the practicability of CSFV.The results showed that the negative and positive samples detected by the two methods were completely consistent.[Conclusion]The CSFV real-time fluorescence RPA method established in this study has mild reaction conditions,rapid nucleic acid amplification,specific and sensitive detection results,which provides a new choice for the diagnosis of CSF.
Key words Classical swine fever virus;Nucleic acid test;Isothermal amplification;Recombinase polymerase amplification(RPA);Polymerase chain reaction
猪瘟,又被称为古典猪瘟(classical swine fever,CSF)、烂肠瘟,是一种感染了猪瘟病毒(classical swine fever virus,CSFV)而引起的高度接触性的急性传染病。该病流行广泛,发病率和死亡率高,是世界动物卫生组织(OIE)规定的通报类传染病[1],在我国《进境动物检疫疫病名录》中列为一类传染病。
重组酶聚合酶扩增(recombinase polymerase amplification,RPA)是一种新型的等温核酸扩增技术,在较低温度下,15~30 min即可完成检测,具有反应条件温和、扩增效率高的优点,并且通过在反应体系中加入荧光探针可实现对扩增对象的实时检测。该研究基于RPA检测技术,针对CSFV基因组的5′端非编码区高度保守序列设计并合成了特异性的引物和exo探针,成功建立了实时荧光重组酶聚合酶扩增检测猪瘟病毒的方法,以期为猪瘟快速诊断提供新的选择。
1 材料与方法
1.1 试验材料
1.1.1 毒株。猪瘟病毒(classical swine fever virus,CSFV)疫苗株(石门株)、猪传染性胃肠炎病毒(transmissible gastroenteritis,TGEV)(IND型)、猪传染性胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae,APP)(AP76)、副猪嗜血杆菌(Haemophilus parasuis,HPS)(SH0165)、猪肺炎支原体(mycoplasma hyopneumoniae,Mhp)(168-L)、猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome,PRRSV)(BIAH-001)、猪圆环病毒2型(porcine cirovirus Type 2,PCV-2)(PM167)、猪水疱病病毒(swine vesieular virus,SVDV)、猪细小病毒(porcine parvovirus,PPV)疫苗株(cp99),由重庆海关技术中心动物检疫实验室保存。
1.1.2 主要试剂。
TaKaRa MiniBEST Viral RNA/DNA Extraction kit、PrimeScriptTM 1st Strand cDNA Synthesis kit、Premix TaqTM、DL2000 DNA Marker、TaKaRa MiniBEST Agarose Gel DNA Extraction kit、PMDTM19-T Vector Cloning kit、DH5a感受态细胞、TaKaRa MiniBEST Plasmid Purification kit,购自宝生物工程(大连)有限公司;细菌基因组DNA提取试剂盒,购自天根生化科技(北京)有限公司;Twist Amp exo kit,购自英国Twist Dx 公司。
1.1.3 主要仪器。
Genie Ⅱ等温扩增荧光检测系统(英国OptiGene);NanoDrop oneC 微量核酸蛋白浓度测定仪(美国Thermo Scientific);Veriti 96多功能梯度PCR仪器(美国Applied Biosystems);GelDoc XR+凝胶成像分析系统(美国Bio-Rad);Centrifuge 5417R高速离心机(德国Eppendorf)。
1.2 试验方法
1.2.1 引物和探针。CSFV 5′NTR由360~374个碱基组成,具有高度保守性。该研究选择该部分序列作为扩增对象,从NCBI下载CSFV基因组5′NTR序列进行分析,参考Twist Amp exo kit关于RPA引物和exo探针的设计要求,利用Primer premier 5软件设计RPA引物和exo探针,委托TAKARA公司合成。引物及探针序列如下:CSFV-RPA-F:5′-GCCATGCCCATAGTAGGACTAGCAAACGGAGGGAC-3′;CSFV-RPA-R:5′-CTCGAGGTGGGCTTCTGCTCACGTCGAACTACTGA-3′;CSFV-RPA-P:5′-GTAGTGGCGAGCTCCCTGGGTGTTCTAAGT(FAM)-(THF)CT(BHQ1)-GAGTACAGGACAG-(P)-3′;其中,FAM为羧基荧光素,THF为四氢呋喃,BHQ1为黑洞猝灭剂 1,P为磷酸盐基团。
1.2.2 病毒核酸的提取。
使用TaKaRa公司的MiniBEST Viral RNA/DNA Extraction kit试剂盒分别提取CSFV、TGEV、PRRSV、SVDV的RNA以及PCR-2和PPV的DNA,使用细菌基因组DNA提取试剂盒分别提取APP、HPS和Mhp的DNA,以上操作过程均在生物安全柜中进行。RNA提取完成后立即使用PrimeScriptTM 1st Strand cDNA Synthesis kit反转录合成第一链cDNA。cDNA和DNA均置-20 ℃冷冻保存备用。
1.2.3 质粒标准品的构建。
CSFV核酸RNA提取后立即进行反转录合成cDNA,以该cDNA作为模板,用设计的CSFV RPA引物(CSFV-RPA-F/CSFV-RPA-R)进行PCR反应。将扩增产物进行琼脂糖凝胶电泳,确定得到预期大小的扩增子并回收,连接到PMDTM-19T载体,转化到DH5α感受态细胞,从阳性克隆中提取质粒,利用紫外可见核酸蛋白分析仪(NanoDrop oneC) 测定其浓度,根据公式:拷贝数=[浓度(ng/μL)×6.02×1023×10-9]/(DNA长度×660)计算质粒拷贝数,-20 ℃保存备用。