南美白对虾两种养殖模式水体微生物群落特征研究
作者: 田涛 窦世龙 姜帅 李红叶 徐后国 郭冉DOI:0.3969/j.issn.004-6755.2025.07.06
Characterization of microbial communities in water from two Litopenaeus vannamei aquaculture systems
TIAN Tao 1,2 ,DOU Shilong1,² ,JIANG Shuai1,² ,LI Hongye1² ,XU Houguo³ ,GUO Ran 1,2 (204 (1.OceanCollege,Hebei Agricultural University,Qinhuangdao O66ooo,China; 2.KeyLaboratoryofNutritionalRegulationandDiseaseControlinAquacultureof Hebei Province,QinhuangdaoO66oo,China; 3.Yellw Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Qingdao 266ooo,China)
Abstract:The experiment was designed with two aquaculture systems for Litopenaeus uannamei : the flow-through aquaculture system as the control group (Group C),and the zero一water exchange aquaculture system as the experimental groups (Groups F and S),each group consisted of 5 concrete tanks with a stocking density of 3OO individuals per square meter and a 6O一day culture period. High -throughput sequencing analysis revealed significant differences in microbial communities between the two systems.Proteobacteria and Bacteroidota were the dominant phyla in both systems,but Bacteroidota exhibited a higher relative abundance system. Functional prediction demonstrated that microbial communities in the zero一water exchange system were more active in pathways such as amino acid metabolism,carbohydrate metabolism,and energy metabolism,providing enhanced nutritional support for the shrimp.
Key words:zero-water exchange aquaculture; flow-water aquaculture;Litopenaeus uannamei ; mi-crobial communities in water
南美白对虾(Litopenaeusvannamei)主要有土池养殖、高位池养殖、工厂化养殖3种养殖模式[1。其中,工厂化循环水养殖综合运用物理、化学、生物等技术手段,把水体中的悬浮物、氨氮、亚硝酸盐、粪便、残饵等进行去除,实现动物的疾病管控和水体的循环利用,避免污染[2],是近年来被广为研究的养殖模式。谭建等[3]发现循环水养殖能提高南美白对虾养殖密度;鲍鹰等4发现在标粗阶段运用生物絮团技术能显著提高虾的总体成活率。
微生物是生态系统中有机物最重要的分解者和初始利用者,在整个生态系统物质循环和能量流动过程中发挥重要作用[5]。传统工厂化流水养殖模式(暗棚)中一般需要定期补充特定菌群以维持高密度养殖环境的稳定,补充的菌种以芽孢杆菌、硝化细菌、EM菌为主,具体补充量与换水量呈负相关。因此,微生态制剂的使用成本约占养殖成本的 5%~20% ,主要取决于技术路径和管理精细化程度。
因此,探究更节能、节水、节药的养殖模式,对南美白对虾养殖的可持续发展具有重要意义。建立稳定的养殖水自稳态系统并明确该系统的稳定因素,是对虾零排水养殖技术能够真正确立并获得广泛认可的关键。研究人员尝试构建一种少换水甚至零换水的南美白对虾养殖体系,并探究其稳定环境中的菌群结构,明确优势菌群种类,并进一步发掘优势菌群特性,为构建节约型对虾养殖模式提供数据支撑。
1材料与方法
1.1 试验设计
试验以北方普遍存在的传统工厂化暗棚流水式养殖模式作为对照(C组),全程不排水只补水养殖模式(零排水模式)为试验组(F、S组)。每个处理5个水泥池 (6m×6m×1m) ,共用10个水泥池,每池养殖密度300尾/ 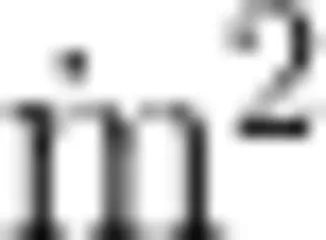 。试验初始对虾为P20虾苗。试验用饲料为工厂化养殖用商业饲料,饲料蛋白 42% 。对照组每天采用 24h 缓慢补水,日换水率 20%~30% ,投喂次数5次/d,总投喂量为对虾体质量的 10%~15% 。试验组提前1个月建立养殖用水自稳态体系。再与对照组一起分别放入300尾/ in2 对虾开始养殖,投喂过程与对照组保持一致。每天检测 pH 值 (7.8~8.5) 、溶解氧 (⩾5mg/L) 、氨氮( <0.5mg/L )、亚硝酸盐 (<0.2mg/L) 等。若任何一个水池水质指标超出常规,停饲一天以稳定水体。
。试验初始对虾为P20虾苗。试验用饲料为工厂化养殖用商业饲料,饲料蛋白 42% 。对照组每天采用 24h 缓慢补水,日换水率 20%~30% ,投喂次数5次/d,总投喂量为对虾体质量的 10%~15% 。试验组提前1个月建立养殖用水自稳态体系。再与对照组一起分别放入300尾/ in2 对虾开始养殖,投喂过程与对照组保持一致。每天检测 pH 值 (7.8~8.5) 、溶解氧 (⩾5mg/L) 、氨氮( <0.5mg/L )、亚硝酸盐 (<0.2mg/L) 等。若任何一个水池水质指标超出常规,停饲一天以稳定水体。
本文为全文原貌 未安装PDF浏览器用户请先下载安装
原版页码:hyby20250717.pd原版全文
1.2 试验地点
唐山禾丰科技有限公司乐亭县养殖场。
1.3水体微生物样品采集与处理
采样点设置为池塘四角。在每个采样点分别采集1L表层水样,在  内用微孔滤膜(上海新亚孔径, 0.45μm) 对水样进行过滤,过滤后的滤膜放入 10mL 无菌离心管中妥善保存。全部样品均放置在 -80∘C 的冰箱内保存,待后续检测分析。选取养殖池塘第30天(F)的样品代表养殖中期、第60天(S)的样品代表养殖末期的水体微生物样品,委托派森诺公司进行高通量测序。
内用微孔滤膜(上海新亚孔径, 0.45μm) 对水样进行过滤,过滤后的滤膜放入 10mL 无菌离心管中妥善保存。全部样品均放置在 -80∘C 的冰箱内保存,待后续检测分析。选取养殖池塘第30天(F)的样品代表养殖中期、第60天(S)的样品代表养殖末期的水体微生物样品,委托派森诺公司进行高通量测序。
2 结果与分析
2.1 水体测序结果
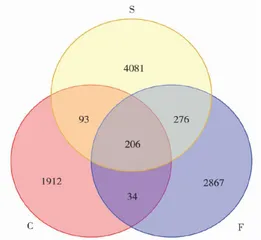
对养殖周期内的水环境微生物群落变化展开分析,最终获取 1025690-1986302 条原始序列,过滤低质量、短长度后的序列 915866-1034172 条,获得有效序列 46573-932477 条。根据养殖水体微生物样本的OTUs(Operational TaxonomicUnits,操作分类单元)绘制成韦恩图(见图1),用于分析9个样品共有和特有OTUs以及之间的关系。由图1可见,9个水体样品汇聚了9469个OTUs,它们共有的206个OTU,S组特有的OTUs有4081个,显著高于C(1912个)和F(2867个)。
2.2 群落结构分析
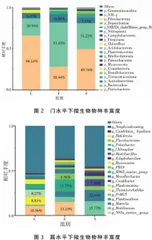
由图2可知,门水平下的物种丰度三个样品组的优势菌门均为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidota),其次是放线菌门(Acti-nobacteriota)。其中F组的拟杆菌门占比( 53.42% )高于其他两组,变形菌门占比(28.44% )显著低于其他两组,放线菌门占比(10.00% 高于其他两组。由图3可知,在属水平下,C组的优势物种为海洋NS3a群(NS3ama-rinegroup),占比为 10.56% ;硫微球菌属(Thio-microhabdus),占比为 8.81% ;浮游菌属(Plank-tomarina),占比为 8.27% 。F组的优势物种为海洋NS3a群,占比为 15.10% ;浮游菌属(Plank-tomarina),占比 13.73% 。S组的优势物种为海生菌属(Marivita),占比为 15.77% 。
2.4水体微生物差异
运用LEfSe(LDAEffectSize)分析对水体微生物群落差异进行分析,筛选出对水体微生物群落具有显著指示作用的物种,见图4。S组中显著富集的分类群最多,且LDA得分普遍较高,与其他组有较大差异,例如:嗜麦芽假单胞菌属(Mo-tilimonas)、纳诺西斯菌属(Nannocystis)、纳诺西斯菌目(Nannocystales)、微杆菌属(Microbacte-rium)。C组和F组中显著富集的分类群相对较少,且LDA得分相对较低。
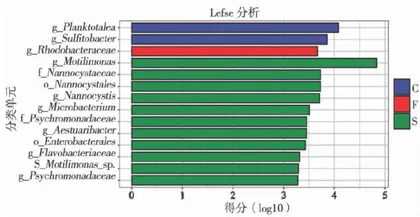
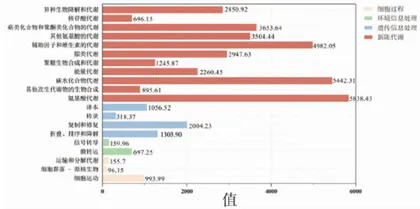
图5功能预测_KEGG
2.5水体微生物功能分析
如图5所示,根据功能分类的条形图可以看出,细胞过程运输和分解代谢的数值为155.70,运输和分解代谢功能在样本中有一定存在,环境信息处理中膜运输的数值为697.25,在样本中有一定存在;氨基酸代谢的数值为5838.43,在样本中非常显著;其他次生代谢物的生物合成的数值为895.61;碳水化合物代谢的数值为5442.31,能量代谢的数值为2260.45,在样本中非常显著;辅因子和维生素的代谢数值为4982.05,在样本中较为显著。氨基酸代谢、碳水化合物代谢、能量代谢等相关功能在样本中占据主导地位,样本中的微生物群落在这些代谢过程中非常活跃。
3讨论
通过对两种南美白对虾养殖模式水体微生物群落的研究,分析了其丰富的物种多样性和复杂的群落结构。在门水平上,变形菌门和拟杆菌门是对照组和试验组的共同优势菌门,这与以往研究中关于水产养殖环境中微生物群落的组成一致[。变形菌门通常具有丰富的代谢功能,能够参与多种有机物的降解和转化,对维持水体环境的稳定具有重要作用[。拟杆菌门则在有机物分解和营养物质循环方面发挥关键作用。中期养殖水体中拟杆菌门的占比显著高于其他两组,而变形菌门的占比则显著低于其他两组,这与中期养殖水体中特定的养殖条件或环境因素有关,如有机物含量、温度、pH值等,这些因素可能影响了微生物群落的组成和结构[8。在属水平上,不同组的优势物种也存在差异。对照组养殖水体的优势物种为海洋NS3a群、硫微球菌属和浮游菌属,这些微生物可能与C组养殖水体特定的环境条件相适应,参与特定的代谢过程。试验组中期养殖水体的优势物种为海洋NS3a群和浮游菌属,而末期养殖水体的优势物种为海生菌属。海生菌属通常具有适应高盐环境的能力9,这可能与S组水体的盐度等环境参数有关。
本文为全文原貌 未安装PDF浏览器用户请先下载安装
原版页码:hyby20250717.pd原版全文