PD-1抑制剂联合新辅助化疗治疗老年三阴性乳腺癌的临床效果
作者: 梁玲 韦长元
摘要:目的 探讨程序性死亡受体1(PD-1)抑制剂联合新辅助化疗治疗老年三阴性乳腺癌(TNBC)的临床效果。方法 回顾性分析2022年1月~2023年12月医院收治的300例老年TNBC患者临床资料,依据治疗方案不同分为对照组和观察组各150例。对照组予以新辅助化疗,观察组予以PD-1抑制剂联合新辅助化疗,比较两组治疗效果及免疫细胞亚群。结果 观察组客观缓解率、疾病控制率均高于对照组
(P<0.05);观察组治疗后CD4+CD25+T、CD4+OX40+T水平均低于对照组(P<0.05)。结论 新辅助化疗联合PD-1抑制剂治疗老年TNBC可有效提高治疗效果,调节免疫细胞亚群,延缓肿瘤进展。
关键词:三阴性乳腺癌;程序性死亡受体1抑制剂;新辅助化疗;肿瘤标志物;不良反应
三阴性乳腺癌(TNBC)是乳腺癌的一种特殊亚型,主要是指组织病理检查结果显示孕激素受体(PR)、雌激素受体(ER)及表皮生长因子受体-2(Her-2)均为阴性,发病率占全部乳腺癌的10%~20%[1~2]。TNBC表现出强烈的侵略性与扩散性,且复发风险高,内分泌治疗、靶向免疫治疗效果欠佳,且老年TNBC患者治疗方案的制定需全面考虑药物耐受性、手术时机等方面。
新辅助化疗目前在临床中应用广泛,并取得良好的治疗效果。《三阴性乳腺癌新辅助铂类应用专家共识(2023版)》指出,TNBC与BRCA1/2基因突变密切相关,约5%~10%乳腺癌患者有此突变,遗传性乳腺癌中约45%涉及BRCA1/2,70%~90%的BRCA1/2突变患者为TNBC,BRCA1/2基因在DNA损伤修复中至关重要,其突变导致肿瘤细胞DNA修复障碍,使患者对铂类化疗药物敏感[3]。同时,越来越多的研究发现程序性死亡受体1(PD-1)抑制剂在抗癌治疗领域具有优势,其通过阻断PD-1和PD-L1结合介导的免疫抑制发挥T细胞抗肿瘤效应,在目前研究报道中尚未发现存在严重不良反应[4]。鉴于此,本研究旨在探讨PD-1抑制剂联合新辅助化疗治疗老年TNBC的应用效果。
1资料与方法
1.1 一般资料
回顾性分析2022年1月~2023年12月医院收治的300例老年TNBC患者临床资料,依据治疗方案不同分为对照组和观察组各150例,均为女性。对照组年龄60~87岁,平均年龄(71.62±5.33)岁;肿瘤直径5~12 mm,平均直径(8.76±2.46) mm。观察组年龄60~85岁,平均年龄(71.43±5.68)岁;肿瘤直径5~11 mm,平均直径(8.63±2.41) mm。两组一般资料比较,差异无统计学意义(P>0.05)。
纳入标准:符合相关临床诊断标准[5],经活检确诊为三阴性乳腺癌;年龄≥60岁;预计生存期≥3个月。排除标准:伴有重大脏器功能障碍;无乳腺手术史;出现远处转移。
1.2 方法
1.2.1 对照组接受新辅助化疗
注射用白蛋白结合型紫杉醇125 mg/m2,于治疗周期第1、8天给药,每21 d治疗1次,连续治疗4周期;注射用顺铂50 mg/m2+0.9%氯化钠溶液1000 mL,分3 d静脉滴注,每21 d治疗1次,连续用药4个周期。
1.2.2 观察组接受PD-1抑制剂联合新辅助化疗
新辅助化疗方案与对照组一致;注射用卡瑞利珠单抗静脉注射,200 mg/次,每隔3周用药1次,连续给药12周。
两组患者均于新辅助化疗结束1周后开展乳腺癌改良根治术,术后依据原方案继续治疗4个周期。
1.3 观察指标
(1)比较两组治疗效果:参照实体瘤临床疗效评价标准(RECIST)1.1版[6]评估。完全缓解(CR),靶病灶消失,病理性淋巴结短直径<10 mm;部分缓解(PR),靶病灶直径降低≥70%;疾病进展(PD),靶病灶直径增加≥20%,出现新病灶≥1个;疾病稳定(SD),病灶增加未达到PD,减少程度未达到RP。客观缓解=CR+PR;疾病控制率=CR+PR+SD。
(2)比较两组免疫细胞亚群:治疗前后抽取患者晨起外周静脉血5 mL,置入肝素抗凝管中送检,使用流式细胞仪检测CD4+CD25+T细胞、CD4+OX40+T细胞水平。
1.4 统计学分析
数据处理采用SPSS22.0统计学软件,计量资料以(±s)表示,采用t检验,计数资料用比率表示,采用χ2检验,P<0.05为差异具有统计学意义。
2结果
2.1 两组治疗效果比较
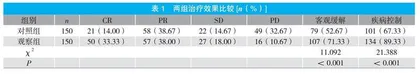
观察组客观缓解率、疾病控制率均高于对照组,两组比较,差异具有统计学意义(P<0.05)。见表1。
2.2 两组免疫细胞亚群比较
两组治疗前CD4+CD25+T、CD4+OX40+T水平比较,差异无统计学意义;观察组治疗后CD4+CD25+T、CD4+OX40+T水平均低于对照组,差异具有统计学意义(P<0.05)。见表2。
3讨论
三阴性乳腺癌不表达ER、PR和Her-2,对内分泌疗法和针对Her-2的靶向疗法都不敏感。这种乳腺癌表现出高度的异质性、侵略性、易转移、复发率高以及预后不良等特征[7~8]。对于早期TNBC患者,手术切除为首选治疗方法。鉴于TNBC的高度异质性和侵袭性,部分患者术后2~3年内仍面临复发风险,复发转移患者5年生存率仅为20%[9~10]。因此,亟需制定新的治疗策略和目标来应对这一挑战。
本研究结果显示,观察组客观缓解率、疾病控制率均高于对照组;两组治疗前CD4+CD25+T、CD4+OX40+T水平比较,差异无统计学意义;观察组治疗后CD4+CD25+T、CD4+OX40+T水平均低于对照组(P<0.05)。TP化疗是三阴性乳腺癌新辅助化疗的常见方案,其独特之处在于结合运用了白蛋白结合型紫杉醇和顺铂,这两种药物在抑制肿瘤细胞增殖方面呈现出协同效应[11~12]。紫杉醇结合白蛋白后作用于微管β位点,促使微管聚集形成束状或团块状结构并维持其稳定性,进而扰乱肿瘤细胞分裂过程;同时,顺铂与DNA碱基相结合,影响其模板链作用,阻碍DNA复制,抑制肿瘤细胞分裂[13~14]。通过单独使用或与其他治疗方法联合应用,免疫检查点抑制剂(ICIs)可以中断免疫抑制信号的传递,重新激活T细胞对肿瘤的免疫反应,从而恢复肿瘤微环境中的免疫活性,实现抗肿瘤效果[15~16]。卡瑞利珠单抗属于PD-1抑制剂类别,其作用机制是阻断PD-1与其配体的结合,从而恢复T细胞活性,使T细胞重新具备攻击肿瘤细胞的能力[17~18]。这些细胞在药物的作用下数量增多,功能增强,能够更有效地释放效应分子颗粒酶B[19~20]。颗粒酶B为重要的细胞毒性分子,能够启动Caspase级联反应,以直接或间接的方式促进肿瘤细胞凋亡。凋亡是一种程序化的细胞死亡方式,对控制肿瘤生长和扩散具有重要意义。此外,卡瑞利珠单抗和顺铂联合使用还能干扰肿瘤细胞的有丝分裂过程,通过靶向作用于α微管蛋白分解机制进一步增强对肿瘤细胞毒性作用,从而抑制肿瘤生长和扩散[21~22]。
综上所述,新辅助化疗联合PD-1抑制剂治疗老年TNBC可有效提高治疗效果,调节免疫细胞亚群,延缓肿瘤进展。
参考文献
[1]战修竹,陈俊.化疗联合PD-1/PD-L1抑制剂治疗三阴性乳腺癌有效性和安全性的Meta分析[J].现代肿瘤医学,2023,31(1):74-81.4-240.
[2]殷雨来,张恒乐,任悦,等.PD-1抑制剂联合新辅助化疗用于老年三阴性乳腺癌患者的效果和安全性分析[J].中国医学创新,2023,20(34):22-26.
[3]中国女医师协会乳腺疾病研究中心.中国进展期乳腺癌共识指南2020(CABC3)[J].癌症进展,2020,18(19):1945-1964.
[4]郝凯峰,张明芳,仲广生.PD-1联合抗血管生成双靶治疗晚期三阴性乳腺癌的疗效及对细胞免疫功能、短期预后和不良反应的影响[J].实用癌症杂志,2022,37(10):1701-1705,1725.
[5]中国抗癌协会乳腺癌专业委员会,中华医学会肿瘤学分会乳腺肿瘤学组,邵志敏.中国抗癌协会乳腺癌诊治指南与规范(2024年版)[J].中国癌症杂志,2023,33(12):1092-1186.
[6]吴文瑶,张谨,郑华,等.世界医学协会《赫尔辛基宣言》:涉及人类受试者的医学研究伦理原则[J].中华疼痛学杂志,2020,16(2):92-95.
[7]黄婉莹,杨向红.三阴性乳腺癌中PD-1、PD-L1的表达与肿瘤浸润性淋巴细胞及临床病理指标的相关性[J].现代肿瘤医学,2022,30(12):2181-2185.
[8]陈进,胡美雪,权毅.基于SEER数据库倾向评分匹配分析术后治疗方案对70岁以上三阴性乳腺癌患者的生存影响[J].遵义医科大学学报,2023,46(3):296-306.
[9]何崇武.肿瘤微环境CAFs中GPER介导能量代谢重塑调控三阴性乳腺癌免疫逃逸的作用与机制研究[D].南昌:南昌大学,2023.
[10]陈君瑶,张文涛,刘巧,等.老年三阴性乳腺癌患者的临床困境和系统治疗策略[J].中国癌症杂志,2023,33(5):506-516.
[11]丁钥,许焱,丁丽,等. 比卡鲁胺联合紫杉醇对雄激素受体阳性三阴性乳腺癌MDA-MB-231细胞的增殖抑制作用[J]. 中华乳腺病杂志(电子版),2018,12(3):135-140.
[12]罗莉.CHEK2基因在三阴性乳腺癌细胞治疗药物耐药中的作用及其机制研究[D].上海:中国人民解放军海军军医大学,2019.
[13]黄喜文,邹小芳,吴国武,等. 诺维本加顺铂一线治疗老年复发转移性三阴性乳腺癌的临床分析[J].中国医药科学,2016,6(5):104-106,118.
[14]章建萍. Caveolin1介导雌激素受体信号通路调控乳腺癌对白蛋白紫杉醇敏感性的作用和机制研究[D]. 杭州:浙江大学,2019.
[15]祝梦娇,罗昆仑,芮小平,等.三阴性乳腺癌组织中LAG-3、PD-1、PD-L1的表达和TIL计数的临床意义[J].现代肿瘤医学,2022,30(11):1961-1966.
[16]张晓宇,任悦,刘伟,等.新辅助化疗联合PD-1抑制剂治疗三阴性乳腺癌的临床疗效[J].天津医药,2023,51(8):847-850.
[17]汤青,孙立柱,张翔,等.三阴性乳腺癌细胞通过PD-1/PD-L1信号通路抑制共培养T细胞活化、增殖及促进其凋亡[J].徐州医科大学学报,2021,41(11):781-786.
[18]邰亦成,蒋敬庭.PD-1/PD-L1抑制剂治疗乳腺癌:现状、问题与对策[J].中国肿瘤生物治疗杂志,2023,30(2):99-107.
[19]黄元夕,张世园.三阴性乳腺癌免疫治疗展望[J].医学研究杂志,2023,52(12):1-4,31.
[20]纪妍,刘森.三阴性乳腺癌靶向治疗相关信号通路及其临床应用[J].中国生物化学与分子生物学报,2022,38(9):1156-1163
[21]龙亚秀.紫杉醇(白蛋白结合型)联合pd-1抑制剂在复发转移三阴性乳腺癌中的临床研究[J].保健文汇,2023,24(16):61-64.
[22]张彬月,贾红燕.紫杉醇/白蛋白紫杉醇为基础的化疗联合PD-1/PD-L1抑制剂治疗三阴性乳腺癌的疗效和安全性:荟萃分析[J].中华普外科手术学杂志(电子版),2023,17(1):52-58.