术前体成分及营养状态对胃肠道肿瘤患者术后低白蛋白血症的影响分析
作者: 宁开燕 吴国焜 林琳
摘要:目的 分析胃肠道肿瘤患者术前身体成分及营养状况对其术后低蛋白血症的影响。方法 回顾性分析2024年2月~2025年2月在医院行切除术治疗的165例胃肠道肿瘤患者临床资料,根据评分结果分为营养良好组(0~1分)、可疑和中度营养不良组(2~8分)、重度营养不良组(≥9分)各55例,分析各组体成分与低蛋白血症的关系。结果 营养良好组、可疑和中度营养不良组、重度营养不良组BMI、上臂围(AC)、体脂百分比、脂肪质量指数(FMI)呈逐渐降低趋势,可疑和中度营养不良组、重度营养不良组AMC、FFMI、相位角指标均低于营养良好组(P<0.05);可疑中度营养不良组、重度营养不良组术后低白蛋白血症发生率均高于营养良好组(P<0.05);Logistic回归分析显示,营养不良、低相位角可增加低白蛋白血症发生风险(P<0.05)。结论 胃肠肿瘤患者脂肪与瘦组织指数低,营养缺乏风险高,营养缺乏与低相位角均可增加术后低蛋白血症发生风险。
关键词:胃肠道肿瘤;脂肪质量指数;营养状态;低白蛋白血症;体脂百分比
胃肠道肿瘤患者常伴有进食障碍和代谢消耗增加,导致营养不良发病率较高[1]。临床研究发现,骨骼肌力量、体积或功能减退与肿瘤患者营养状况及预后密切相关,肌肉减少症是胃癌术后不良预后的独立风险因素[2~3]。术后应激阶段,机体通常会呈现出炎性分解状态,并迅速合成急性期反应蛋白,导致对氨基酸的需求量增加,进而加剧肌肉组织分解。胃肠道肿瘤患者手术后应激反应可能引起炎症和血管通透性增加,导致血清白蛋白水平下降。本研究旨在分析胃肠道肿瘤患者术前身体成分及营养状况对其术后低蛋白血症的影响。
1 资料与方法
1.1 一般资料
回顾性分析2024年2月~2025年2月在医院行切除术治疗的165例胃肠道肿瘤患者临床资料,由营养师采用主观整体评估量表(PG-SGA)评估患者营养状态,根据评分结果分为营养良好组(0~1分)、可疑和中度营养不良组(2~8分)、重度营养不良组(≥9分)各55例。
纳入标准:均经病理组织活检确诊为结直肠癌或胃癌;行外科手术治疗;入院72 h内评估PG-SGA。排除标准:不能开展体成分分析,如装有心脏点除颤器、截肢等;住院时间<24 h;伴有认知障碍或精神疾病。
1.2 方法
1.2.1 营养评估
患者入院48 h内,由营养师开展PG-SGA评估,根据评分结果分为营养良好组(0~1分)、可疑和中度营养不良组(2~8分)和重度营养不良组(≥9分)各55例。
1.2.2 体成分分析
采用多频生物电阻抗分析仪检测,根据标准检测身高后,通过手及脚上的8个触碰式电极进行测量,包括蛋白质含量、去脂体重、体脂含量、骨髓肌质量、上臂围(AC)、上臂肌围(AMC)、体细胞量(BCM)、相位角等,计算体重指数(BMI)、脂肪质量指数(FMI)、去脂体重指数(FFMI)及骨髓肌指数(SMI)。
1.2.3 低白蛋白血症评估
于术后1 d复查的蛋白水平,血液蛋白含量<35 g/L判定为低白蛋白血症。
1.3 统计学方法
数据处理采用SPSS19.0统计学软件,计量资料以(±s)表示,采用t检验,计数资料用比率表示,采用χ2检验,影响因素采用Logistic回归分析,P<0.05为差异具有统计学意义。
2 结果
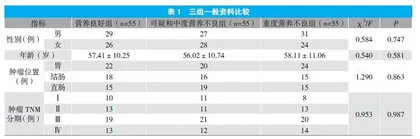
2.1 三组一般资料比较
三组性别、年龄、肿瘤位置、肿瘤TNM分期等一般资料比较,差异无统计学意义(P>0.05)。见表1。
2.2 三组体成分分析结果比较
营养良好组、可疑和中度营养不良组、重度营养不良组BMI、AC、体脂百分比、FMI指标呈逐渐降低趋势发展;可疑和中度营养不良组、重度营养不良组AMC、FFMI、相位角指标均低于营养良好组,差异具有统计学意义(P<0.05);三组蛋白质量、BCM比较,差异无统计学意义(P>0.05)。见表2。
2.3 术后低白蛋白血症影响因素分析
以低白蛋白血症为因变量,以PG-SGA分级、SMI、FMI、相位角为自变量进行Logistic回归分析表明,营养不足、低相位角可增加低白蛋白血症发生风险为低白蛋白血症预测风险因素(P<0.05)。见表3。
3 讨论
胃肠道癌症患者手术治疗前一般伴有不同程度的营养不足,手术创伤会引起机体应激反应,导致高代谢以及蛋白质重新分布、丢失[4]。术后初期,患者因为不能正常进食使体重逐步下降,伴随明显的疲乏,器官功能也呈现出各种程度的损害,一定程度上加重营养缺失,不利于术后康复[5]。
细胞量对物质和能量代谢至关重要,恶性肿瘤患者往往水分和细胞内液减少,细胞外液增多,这表明瘦体组织和细胞群减少。相位角反映细胞膜的完整性和功能,受多种疾病影响。相位角值高表示细胞完整性好、功能强;相位角值低意味着细胞完整性受损,功能下降,细胞凋亡增多,即使细胞数量不变,相位角也可能因细胞膜通透性变化而改变[6]。相位角是预测肺癌和大肠癌患者死亡风险的要素,并作为评估外科手术和老年患者营养状况的灵敏指标,通过观察相位角改变,医生能更精确地掌握患者营养状况,从而调整治疗和护理方案[7]。本研究结果表明,营养良好组、可疑和中度营养不良组、重度营养不良组BMI、上臂围(AC)、体脂百分比、脂肪质量指数(FMI)呈逐渐降低趋势,可疑和中度营养不良组、重度营养不良组AMC、FFMI、相位角指标均低于营养良好组(P<0.05);可疑中度营养不良组、重度营养不良组术后低白蛋白血症发生率均高于营养良好组(P<0.05)。胃肠道肿瘤患者术前可能出现肿块阻塞消化道导致吞咽梗阻、进食障碍,或由于放化疗副作用,如恶心、呕吐等导致食欲缺乏或食入即吐,从而减少蛋白质及其他营养物质摄入。同时,胃肠道肿瘤患者术后胃或肠被大部分切除,消化功能受损,营养吸收不良,导致合成白蛋白的营养物质减少,白蛋白水平降低。白蛋白主要在肝脏合成,胃肠道肿瘤患者进行抗肿瘤治疗,如化疗、靶向治疗、免疫治疗等时容易出现药物性肝损伤[8~9]。部分患者因肝脏肿瘤导致功能受损,白蛋白合成减少,肝肾功能不全患者蛋白质丢失,从而加重低蛋白血症。本研究中Logistic回归分析显示,营养不良、低相位角可增加低白蛋白血症发生风险(P<0.05)。营养不良,尤其是蛋白质摄入不足或消化吸收障碍会导致机体白蛋白合成减少,进而引发低白蛋白血症[10]。研究表明[11~12],相位角与血清白蛋白水平呈正相关,即相位角较高的个体往往具有较高的血清白蛋白水平。因此,相位角可以作为评估机体营养状态和预测低白蛋白血症发生风险的中药指标。对于已经发生低白蛋白血症的患者,应根据具体病因采取相应的治疗措施,如增加蛋白质摄入、改善消化吸收功能、控制炎症等。对于存在营养不良风险的人群,应定期进行营养评估,包括相位角测量、体成分等,及时发现并干预。
综上所述,胃肠肿瘤患者脂肪与瘦组织指数低,营养缺乏风险高,营养缺乏与低相位角均可增加术后低蛋白血症发生风险,临床应密切观察这些指标并及时予以干预,从而有效预防低白蛋白血症。
参考文献
[1]陈镇燕,朱丽.胃肠道恶性肿瘤患者的人体成分分析[J].肿瘤防治研究,2019,46(10):911-915.
[2]张东焕.外泌体在胃肠道肿瘤诊治中的应用[J].实用肿瘤杂志,2021,36(4):300-305.
[3]王方,于康,马志强.胃肠道良、恶性肿瘤患者围术期体重、骨骼肌及体脂肪变化比较[J].中华临床营养杂志,
2021,29(2):90-95.
[4]张莹,朱永健.360例胃肠道肿瘤患者术前合并肌肉减少症的现状及影响因素分析[J].护理学报,2023,30(8):17-22.
[5]芮红霞,张冬婷,张晓雨,等.GLIM标准在胃肠道恶性肿瘤患者营养不良诊断中的应用研究[J].肿瘤代谢与营养电子杂志,2023,10(1):113-119.
[6]邱琼,张静,陈格亮,等.骨骼肌质量指数对胃肠道恶性肿瘤患者术后并发症及再入院率的影响[J].同济大学学报(医学版),2022,43(6):776-781.
[7]李怡,周福祥,李秦阳,等.CT相关骨骼肌参数在胃肠道肿瘤中的临床进展[J].肿瘤代谢与营养电子杂志,
2019,6(4):494-498.
[8]黄子菁,王颖,朱丽,等.胃肠道恶性肿瘤患者肌少症状况及影响因素分析[J].护理学杂志,2023,38(5):50-53.
[9]仇静霞,林艳娟,王雪丰,等.肌肉衰减症对老年胃肠道肿瘤患者活动能力和营养状况的影响[J].中华临床营养杂志,2022,30(3):134-140.
[10]翟紫娟,李燕,马翠翠,等.瘦素、脂联素在胃肠道肿瘤中的作用及其机制研究进展[J].世界最新医学信息文摘,
2021,21(41):155-156.
[11]周路琦,孙超,程艳芬,等.胃肠道恶性肿瘤患者围手术期肠外营养的治疗效果[J].东南大学学报(医学版),
2017,36(2):213-216.
[12]秦琳,王青.患者参与式饮食干预对胃肠道肿瘤患者术后营养状况的影响[J].当代护士,2023,30(31):73-76.