高效液相色谱-串联质谱法测定鸡蛋中的甲硝唑和地美硝唑
作者: 卢薇,左文婧,丁石花
摘 要:目的:建立高效液相色谱-串联质谱法测定鸡蛋中甲硝唑和地美硝唑残留的方法。方法:样品依次用乙酸乙酯提取,正己烷除脂,混合阳离子交换固相萃取柱净化后,使用Shimadzu VP-ODS C18色谱柱分离,以0.1%甲酸水和0.1%甲酸乙腈为流动相进行洗脱,多反应监测正离子扫描,外标法定量。结果:甲硝唑和地美硝唑的质量浓度在0~400 μg·L-1时线性关系良好,检出限和定量限分别为0.5 μg·kg-1和1.0 μg·kg-1。在0.5 μg·kg-1、1.0 μg·kg-1、5.0 μg·kg-1 3个加标水平下,精密度和加标回收率均符合要求。结论:该方法前处理简单、重现性好、回收率高,适用于大批量鸡蛋中甲硝唑、地美硝唑残留的测定。
关键词:高效液相色谱-串联质谱法;鸡蛋;甲硝唑;地美硝唑
Determination of Metronidazole and Dimenidazole in Eggs by High-Performance Liquid Chromatography Mass Spectrometry
LU Wei, ZUO Wenjing, DING Shihua
(Baoji Food and Drug Inspection and Testing Center, Baoji 721000, China)
Abstract: Objective: To establish a method for the determination of metronidazole and dimenidazole in eggs by high performance liquid chromatography-tandem mass spectrometry. Method: The samples were extracted with ethyl acetate, degreased with n-hexane, and cleaned up with a mixed cation exchange solid phase extraction column. The samples were separated on a Shimadzu VP-ODS C18 column with 0.1% formic acid water and 0.1% formic acid acetonitrile as the mobile phases. Multiple reaction monitoring positive ion scanning and external standard method were used for quantification. Result: The linear relationship between metronidazole and dimenidazole was good in the range of 0~400 μg·L-1, and the limits of detection and quantification were 0.5 μg·kg-1 and 1.0 μg·kg-1, respectively. At the three spiked levels of 0.5 μg·kg-1, 1.0 μg·kg-1, and 5.0 μg·kg-1, the precision and spiked recovery rates met the requirements. Conclusion: This method has simple pretreatment, good reproducibility, and high recovery rate, and is suitable for the determination of metronidazole and dimenidazole in large quantities of eggs.
Keywords: high-performance liquid chromatography mass spectrometry; eggs; metronidazole; dimenidazole
甲硝唑、地美硝唑属于人工合成的硝基咪唑类药物,对鸡生殖系统疾病、肠道和组织的厌氧菌感染、家禽的滴虫病感染等有较好的疗效[1]。同时,此类药物可作为牛、猪、禽的生长促进剂,能提高饲料转化率[2]。硝基咪唑类药物及其代谢产物进入动物体内会有不同程度的残留,而这些动物性食品进入人体后,可能引起细胞诱变和遗传毒性作用,从而影响人体健康[3]。欧盟和美国将二者列为禁用兽药,而日本规定二者不得在食品中检出[4]。我国制定的《食品安全国家标准 食品中兽药最大残留限量》(GB 31650—2019)中规定允许二者作治疗用兽药,但在动物源性食品中不得检出[5]。
鸡蛋含有丰富的蛋白质、脂肪、卵磷脂等营养成分,因此一直以来都是居民日常饮食中的重要组成部分。我国目前制定和发布的硝基咪唑类药物检测方法标准中只有《动物源性食品中多种碱性药物残留量的检测方法 液相色谱-质谱/质谱法》(SN/T 2624—2010)有针对鸡蛋的前处理方法,但提取过程需要反复转移样液,旋转蒸发,并且使用两种固相萃取柱净化,步骤较复杂,回收率低。本实验旨在确保回收率的前提下,寻找一种简便的前处理方式,使其适于检测大批量样品。
1 材料与方法
1.1 材料与试剂
市售鸡蛋,去壳后均质,-18 ℃以下保存。
甲醇、正己烷、乙腈(色谱纯),DIKMA;甲酸(色谱纯),天津市大茂化学试剂厂;乙酸乙酯(色谱纯),Knowles诺尔施;浓盐酸,四川西陇科学有限公司;氨水,天津北联;甲硝唑有证标准物质,浓度99.3%,TM Standard;地美硝唑有证标准物质,浓度99.9%,TM Standard;实验用一级水;Agela混合阳离子交换固相萃取柱,60 mg,3 mL。
1.2 仪器与设备
液相色谱-质谱/质谱仪:ESI源,美国赛默飞科技有限公司;SQP Practum224-1CN电子天平,赛多利斯科学仪器(北京)有限公司;VG3涡旋混匀器,IKA;TG16-WS离心机,湖南沪康离心机有限公司;MTN-2800D氮吹仪,天津奥特塞思斯仪器有限公司。
1.3 液相色谱-质谱/质谱条件
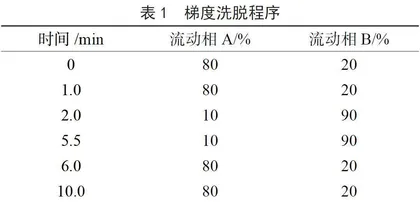
(1)液相色谱条件。LC-30AD系统;流动相:A为0.1%甲酸水,B为0.1%甲酸乙腈溶液;色谱柱:Shimadzu VP-ODS C18(150 mm×2.0 mm,4.6 μm);柱温:35 ℃;流速:0.30 mL·min-1;进样体积:2 μL;洗脱方式:梯度洗脱,时间程序见表1。
(2)质谱条件。LCMS-8030系统;扫描模式:多反应监测(Multiple Reaction Monitoring,MRM);离子源:ESI+;离子源接口电压:4.5 kV;干燥气:N2(流量15 L·min-1);雾化气:N2(流量3.0 L·min-1);碰撞气:Ar;加热模块温度:400 ℃;脱溶剂管温度:200 ℃;驻留时间:100 ms;延迟时间:3 ms。
1.4 样品前处理
称取2 g(准确至0.1 mg)试样于50 mL离心管中,加入15 mL乙酸乙酯,旋涡混匀2 min,10 000 r·min-1离心5 min。取上清液于另一50 mL离心管中,残渣中加入15 mL乙酸乙酯,重复提取一次,将两次提取液合并于25 ℃氮吹干。残余物中加0.1 mol·L-1盐酸溶液5 mL,旋涡1 min充分溶解,加入正己烷5 mL,振摇1 min,5 000 r·min-1离心5 min,弃正己烷层。下层再加5 mL正己烷重复除脂一次,弃正己烷层,备用。
依次用甲醇2 mL和0.1 mol·L-1盐酸溶液2 mL活化固相萃取柱,取备用液过柱,依次用0.1 mol·L-1盐酸溶液2 mL、甲醇1 mL和2%氨水1 mL淋洗,2 mL洗脱液洗脱。收集洗脱液,35 ℃氮吹干,加水1 mL,涡旋1 min,滤膜过滤,供测定。取空白试料,除不加药物外,同上步骤处理。
1.5 标准溶液的配制
称取甲硝唑和地美硝唑标准品各10 mg,用甲醇溶解并稀释定容,分别配制成1 mg·mL-1的标准储备液。吸取上述储备液各10 μL,用甲醇分别定容至10 mL,配制成1 μg·mL-1的标准工作液。取经上述提取和净化的空白试料溶液,分别加入适量的标准工作液,35 ℃氮吹干,加水1 mL,涡旋1 min,配制成浓度为0 μg·L-1、2 μg·L-1、4 μg·L-1、20 μg·L-1、40 μg·L-1、200 μg·L-1和400 μg·L-1的基质标曲溶液并上机测定。
2 结果与分析
2.1 质谱和色谱条件的优化
2.1.1 质谱条件的优化
在正离子扫描和MRM模式下,多次测定100 ng·mL-1的甲硝唑和地美硝唑标准溶液,对质谱参数进行优化,结果见表2。选择稳定性好、干扰小、相对离子丰度高的碎片离子作为定量离子和定性离子,并以响应值最高、丰度最强的离子对作为定量离子对。定量离子的MRM图见图1,特征离子扫描质谱图见图2。
2.1.2 液相条件的优化
试验对比了以下3组流动相组合:①甲醇-5 mmol·L-1乙酸铵溶液;②0.1%甲酸乙腈-0.1%甲酸2 mmol·L-1乙酸铵水溶液+甲醇(95+5);③0.1%甲酸水-0.1%甲酸乙腈。其中,第3组流动相组合响应值最好,且出峰效果最佳,因此选择0.1%甲酸水-0.1%甲酸乙腈为流动相进行洗脱。
2.2 提取条件的选择和优化
甲硝唑和地美硝唑在乙酸乙酯和乙腈中具有较好的溶解性。鸡蛋中加入乙腈后,易形成果冻状物质,影响提取效果。而加入乙酸乙酯后可较好地提取目标物质,离心后正己烷除脂,通过混合阳离子交换固相萃取柱净化去除杂质干扰。
2.3 方法学评价
2.3.1 线性关系
用空白基质按照上述方法处理,配制相应的基质标曲溶液上机测定,以峰面积对浓度进行线性回归,甲硝唑的线性回归方程为f(x)=0.498 004x,相关系数R2=0.999 3;地美硝唑的线性回归方程为f(x)=360.416x,相关系数R2=0.999 2。结果表明,二者在0~400 μg·L-1都呈现良好的线性关系。
2.3.2 检出限和定量限
准确称取11份阴性样品,加入一定浓度的标准溶液,按照上述方法处理,检出限为信噪比≥3时的浓度,定量限为信噪比≥10时的浓度,得到甲硝唑和地美硝唑的检出限均为0.5 μg·kg-1,定量限均为1.0 μg·kg-1。
2.3.3 精密度和回收率
称取阴性样品,按照0.5 μg·kg-1、1.0 μg·kg-1和5.0 μg·kg-1 3个水平分别加入相应的标准工作液适量,按照上述方法处理,每个水平重复测定6次,精密度和加标回收率测定结果见表3。结果表明,甲硝唑和地美硝唑的精密度和加标回收率均符合《实验室质量控制规范 食品理化检测》(GB/T 27404—2008)的要求。
2.3.4 实际样品测定
为了进一步验证方法的有效性,选择市售的多批鸡蛋样品进行检测,测定回收率在82.1%~103.2%,相比于SN/T 2624—2010的前处理方法,此方法前处理高效简便,提高了提取效率,适用于检测大批量样品。
3 结论
本文建立了检测鸡蛋中甲硝唑和地美硝唑的方法。本方法线性良好,前处理方法较SN/T 2624—2010中的方法简单,回收率高,可应用于大批量食品检测。后续还将继续研究,将此方法应用于其他基质中硝基咪唑类药物残留的检测。
参考文献
[1]杜乐,喻世静,殷智鑫,等.硝基咪唑类药物的研究进展[J].化学世界,2020,61(2):92-98.
[2]郭礼强,张金玲,李凯,等.HPLC-MS/MS法测定饲料中甲硝唑和二甲硝咪唑含量[J].中国兽药杂志,2017,51(1):52-56.
[3]陈培荣,刘锦妮,李洵,等.饲料中硝基咪唑类药物的GC-MS检测方法[J].江苏农业科学,2013,41(7):292-293.
[4]李锐,钱鸣蓉,肖英平,等.国内外水禽产品中兽药残留限量标准比对分析[J].农产品质量与安全,2017(6):28-31.
[5]农业农村部,国家卫生健康委员会.食品安全国家标准 食品中兽药最大残留限量:GB 31650—2019[S].北京:中国标准出版社,2019.