评估膳食磷摄入有效公式的建立研究
作者: 孟德姣 程懿 李晶晶 何慧敏 胡雯
摘 要:目的:探索基于蛋白质摄入预测患者磷摄入的有效公式。方法:对华西医院及成都医学院第一附属医院CKD管理中心随访的68名CKD 3~5期非透析患者的饮食蛋白质、磷摄入情况进行分析。结果:共纳入68例CKD 3~5期非透析患者,饮食记录计算所得的磷与Boaz公式通过膳食蛋白质摄入计算所得的患者的磷摄入量相关系数为0.906(P<0.001);膳食中的蛋白质和磷呈线性相关(P<0.001);建立了根据饮食中蛋白质摄入推测磷摄入量的回归方程:(饮食)P(mg)=53.9(mg)+饮食蛋白(g)×14.2(mg/g),该预测方程能解释90.6%的磷摄入量变化(R=0.906)。结论:饮食中的蛋白质和磷呈线性相关,建立了基于膳食中蛋白质摄入推测磷摄入量的回归方程。
关键词:慢性肾脏病;低蛋白质饮食;膳食磷摄入
近年来,慢性肾脏病(CKD)在全球的发病情况逐年升高。研究表明,血清磷浓度越高,肾脏疾病的发展进程就会越快,并且出现终末期肾病(ESRD)的风险也会越高[1-4]。持续存在的高磷血症会引起继发性甲状旁腺功能亢进、肾性骨营养不良、血管钙化及增加心血管系统发病和死亡风险[5-8]。磷主要来自于食物,血磷水平在一定程度上可以反映磷摄入量[9],所以限制膳食中磷的摄入是防治高磷血症的重要治疗手段,如何有效准确的评价CKD患者的磷摄入量是目前营养管理中亟待解决的问题。食物中的磷主要与蛋白质结合存在于细胞内,磷富含在膳食蛋白质中[9]。临床营养师可通过肾病食物交换份迅速地估算出膳食中蛋白质的摄入量。Boaz等[10]研究发现,磷和蛋白的摄入呈显著正相关,并对104名CKD患者的磷和蛋白的摄入进行了回归,得出回归方程如式(1):
(饮食)P(mg)=128(mg)+膳食蛋白质(g)×14(mg/g)(1)
这提示可通过膳食蛋白质摄入量估算膳食磷摄入,但该研究者选择的人群为以色列人,与我国的膳食模式差异巨大。本研究旨在验证Boaz建立回归方程通过膳食蛋白质摄入量来评价磷摄入的可行性,并在中国CKD患者中初步探索基于膳食蛋白摄入推测膳食磷摄入的有效公式。
1 资料与方法
1.1 研究对象
选择2015年10月—2016年6月在华西医院及成都医学院第一附属医院CKD管理中心随访的68名CKD 3~5期非透析患者作为研究对象,接受标准的CKD治疗及由临床营养师提供的营养治疗教育。病人纳入研究前已在CKD管理中心定期随访6个月以上,并在营养师指导下经过了为期3~6个月的饮食指导及记录饮食方法的培训。
1.2 研究内容
1.2.1 观察指标 (1)一般情况:包括患者性别、年龄、身高、体重、随访时间、疾病合并情况、危险因素及营养相关治疗行为。(2)肾功能指标:CREA(μmol/L)、BUN(mmol/L)、UA(mmol/L)。(3)由3 d饮食记录(称重法)得到患者实际的饮食种类和摄入数量,再根据《中国食物成分表》(第6版)计算获得能量、蛋白质、脂肪、碳水化合物及磷的实际摄入水平(由3 d饮食记录取平均值)。(4)根据Boaz建立的回归方程,由膳食蛋白质计算得到磷的摄入量。
1.2.2 统计分析 原始资料统一录入Excel表格,采用SPSS 19.0软件进行统计描述和统计分析,计量资料采用±s进行统计描述,计数资料采用频数(构成比)进行统计描述。 P≤0.05将被认为所检验的差别有统计学意义。对3 d饮食记录所得的磷摄入量与通过Boaz公式计算患者的磷摄入量进行Pearson相关分析。应用线性回归的方法建立食物中蛋白质和磷摄入的回归方程。
2 结果与分析
2.1 一般情况
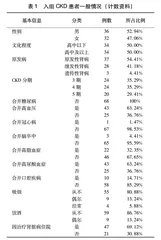
共纳入符合入选标准、并能定期接受标准的CKD治疗及由临床营养师定期提供营养教育者68例。患者年龄在21~75岁之间,男性36例、女性32例;文化程度高中以下者34例(50.00%);平均血CREA为(264.90±137.21)μmol/L,平均eGFR为(27.36±15.55)mL/(min·1.73 m2)(表1、表2)。营养相关治疗行为中,规律补充钙剂30例(44.12%)、规律补充补铁药物35例(51.47%)、定期注射促红素30例(44.12%)、α-酮酸服用40例(58.82%)(表3)。
2.2 CKD患者膳食调查能量及营养物质摄入量
通过3 d饮食记录(称重法)计算获得入组68例CKD患者能量及营养物质的3 d平均摄入量,总体每日平均蛋白质摄入量为(46.69±11.06)g/d,平均磷摄入量为(718.90±173.79)mg/d,根据Boaz建立的公式由膳食蛋白质摄入计算得到磷摄入量的平均值为(781.71±154.82)mg/d(表4)。
2.3 膳食磷摄入量与通过Boaz建立公式计算磷摄入量相关性分析
通过对68例CKD患者3 d饮食记录计算所得的磷摄入量与Boaz建立的公式通过膳食蛋白质摄入计算所得的膳食磷摄入量进行Pearson相关分析,相关系数为0.906(P<0.001),有统计学意义(图1)。
2.4 建立蛋白质和磷的回归方程
根据已发表的公式[10-11],膳食中的蛋白和磷呈线性相关。由3 d饮食记录所获得的蛋白质和磷摄入量也呈线性相关(图2)。F检验显示P值<0.001,说明自变量(蛋白质)能够有效预测因变量(磷)。应用线性回归的方法建立蛋白和磷的回归方程如式(2):
(饮食)P(mg)=53.9(mg)+膳食蛋白质(g)×14.2(mg/g)(2)
该预测方程能解释90.6%的磷摄入量变化(R=0.906),应用拟合度优先进行检验,比如检验残差及调整后的判定系数(R2=0.821),以及预测变量对因变量的显著性等进行检验,P值均小于0.001,该模型及预测变量均有统计学意义(表5)。
3 讨论
磷在食物中分布很广,无论动物性食物或植物性食物中都富含磷,磷常与蛋白质并存,平均每克蛋白质含磷12~16 mg[9,12]。磷主要由肾脏排泄,限制饮食中磷的摄入是防治CKD患者高磷血症的重要治疗手段[2]。根据已发表的公式[10-11],膳食中的蛋白质和磷呈线性相关。Boaz等[10]对104名CKD患者的磷和蛋白质的摄入进行了回归,得出回归方程如式(3),即根据膳食蛋白质摄入量就可以预测膳食中磷元素的含量:
(饮食)P(mg)=128(mg)+膳食蛋白质(g)×14(mg/g)(3)
张译文[13]对中国医科大学附属第一医院的110例CKD患者通过Boaz公式评估磷摄入量,并与实际摄入量进行比较,认为两者无统计学差异,Boaz公式适合评估我国CKD患者磷实际摄入量。对本研究中纳入的68例CKD患者饮食记录计算所得的磷摄入量与Boaz建立公式通过膳食蛋白质摄入计算所得的磷摄入量进行相关性分析,相关系数为0.906(P<0.001),相关有统计学意义,这也验证了通过膳食蛋白质摄入用线性回归方程来推测膳食磷摄入量的可行性。本研究中,由饮食记录所获得的蛋白质和磷摄入量也呈线性相关,应用线性回归的方法建立了蛋白质和磷的回归方程如式(4):
(饮食)P(mg)=53.9(mg)+膳食蛋白质(g)×14.2(mg/g)(4)
该预测方程能解释90.6%的磷摄入量变化(R=0.906),方程应用拟合度优先进行检验以及预测变量对因变量的显著性等进行检验,均有统计学意义。该方程与Boaz建立的回归方程比较,两者常数项与回归系数均不同,这可能是由于中西方膳食模式不同造成的[14-17]。食物中磷除了存在于蛋白质中,还常见于各种加工类食物[18]。据Calvo[19]的研究,加工过程中加入的磷酸盐添加剂可以使额外的磷摄入量达到500 mg/d。食品加工中常用的磷酸盐添加剂为磷酸氢二钠、三聚磷酸钠等,这种添加的无机磷没有与蛋白质结合,在肠道中吸收率可达80%~100%[11],远高于食物中天然存在的有机磷40%~60%的吸收率[18],会导致CKD患者血清磷浓度显著增加[20]。CKD患者应尽量避免食用含有磷酸盐添加剂的食物,而国外膳食搭配中加工类食物相对比例较高[14-17],若盲目照搬国外的研究结果,可能会造成实际应用中对我国CKD患者磷摄入量过高的估计,并不能对临床应用起到实际指导意义。
本研究建立的根据膳食中蛋白质摄入量推测磷摄入量的回归方程,是依据本土膳食模式得到的,更符合实际情况,以快速、准确的评价磷摄入量,其具体应用有待于多中心、更大样本量的研究来进行验证,使临床营养师和CKD患者早日获益。
参考文献
[1]L Zhang,F Wang,L Wang,et al.Prevalence of chronic kidney disease in China:a cross-sectional survey[J].Lancet,2012,379(9818):815-822.
[2]M Tonelli,N Pannu,B Manns.Oral phosphate binders in patients with kidney failure[J].N Engl J Med,2010,362(14):1312-1324.
[3]N Voormolen,M Noordzij,D C Grootendorst,et al.High plasma phosphate as a risk factor for decline in renal function and mortality in pre-dialysis patients[J].Nephrol Dial Transplant,2007,22(10):2909-2916.
[4]U Selamet,et al.Relationship of dietary phosphate intake with risk of end-stage renal disease and mortality in chronic kidney disease stages 3-5:the modification of diet in renal disease study[J].Kidney Int,2016,89(1):176-184.
[5]W N Suki,L W Moore.Phosphorus regulation in chronic kidney disease[J].Methodist Debakey Cardiovasc J,2016,12(4 Suppl):6-9.
[6]A P McGovern,S de Lusignan,J van Vlymen,et al.Serum phosphate as a risk factor for cardiovascular events in people with and without chronic kidney disease:a large community based cohort study[J].PLoS One,2013,8(9):e74996.
[7]M Kanbay,et al.Serum sclerostin and adverse outcomes in nondialyzed chronic kidney disease patients[J].J Clin Endocrinol Metab,2014,99(10):E1854-61.
[8]Yoon,CY,et al.High dietary phosphorus density is a risk factor for incident chronic kidney disease development in diabetic subjects:a community-based prospective cohort study[J].Am J Clin Nutr,2017,106(1):311-321.