测试片法在乳制品金黄色葡萄球菌快速检测中的应用研究
作者: 董彬
摘 要:本研究为探索金黄色葡萄球菌测试片定性检测乳制品中金黄色葡萄球菌的可行性,依据国际标准ISO 16140-2:2016,以《食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验》(GB 4789.10—2016)第一法为参比方法,对测试片法的包容性和排他性、灵敏度和一致性进行验证。结果表明,各参数指标均满足ISO 16140-2:2016中对于定性方法验证指标的要求。金黄色葡萄球菌测试片法的检测效果与GB 4789.10—2016第一法的标准方法相当,可作为替代方法,用于定性检测乳制品中的金黄色葡萄球菌。
关键词:测试片;金黄色葡萄球菌;乳制品
Application of the Count Plate Method in the Detection of Staphylococcus aureus of Dairy Products
DONG Bin
(Beijing Guangming Jianeng Dairy Co., Ltd., Beijing 101300, China)
Abstract: In this study, in order to explore the feasibility of Staphylococcus aureus count plate for qualitative detection of Staphylococcus aureus in dairy products, according to the international standard ISO 16140-2:2016, the first method of GB 4789.10—2016 was used as the reference method, and the inclusiveness, exclusivity, sensitivity and consistency indexes with the reference method were verified. The results show that all parameters meet the requirements of ISO 16140-2:2016 for qualitative method validation. In summary, the detection effect of Staphylococcus aureus count plate method is comparable to the standard method of GB 4789.10—2016, and can be used as an alternative method for qualitative detection of Staphylococcus aureus in dairy products.
Keywords: count plates; Staphylococcus aureus; dairy product
金黄色葡萄球菌是乳制品质量安全的主要风险因子之一。近年来,国内外多次发生由金黄色葡萄球菌污染引发的乳制品食品安全事件[1]。乳制品在加工、包装、运输及储藏等环节均有被金黄色葡萄球菌污染的可能[2],如果该菌株携带有毒力基因,在适宜的条件下菌体会大量繁殖,同时产生金黄色葡萄球菌肠毒素,进而造成食物中毒。我国《食品安全国家标准 预包装食品中致病菌限量》(GB 29921—2021)[3]对于巴氏杀菌乳、调制乳、发酵乳、加糖炼乳(甜炼乳)和调制加糖炼乳要求采用比较严格的二级采样方案,金黄色葡萄球菌的限量为n=5,c=2,m=0/25 g(mL)。检验方法按照《食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验》(GB 4789.10—2016)第一法[4]金黄色葡萄球菌定性检验执行。
GB 4789.10—2016第一法虽然是“金标准”方法,但检测周期长,一般为3~4 d,BP平板和血平板菌落形态的识别与判读相对复杂,还容易受样品基质、培养基以及检测条件的影响,无法满足乳制品加工企业在实际工作中对“快速、易操作”的需求。随着检测技术的发展和国际标准化的合作,越来越多的微生物检验方法标准中引入了测试片法。MicroFast®金黄色葡萄球菌测试片法(以下简称“测试片法”)是用一种预先制备的含有指示剂及冷水可溶性凝胶的培养基系统进行微生物培养的方法。培养基中含有金黄色葡萄球菌生长的主要营养物质和功能性物质。金黄色葡萄球菌在生长代谢过程中产生的酶与测试片中的显色底物发生反应,释放显色基团,累积后信号放大,在可见光下显示紫色菌落。
测试片法以其良好的灵敏度、特异性、排他性等技术优势在各乳制品生产企业广泛应用。测试片法与GB 4789.10—2016第一法相比,在检测时间上仅需48 h,而GB 4789.10—2016第一法最少需要77 h左右。测试片法可以帮助企业提高检测效率、缩短检测时间、加快产品放行,同时操作更为简便、更加节省空间,从而减少了实验误差,并降低了能耗。
本研究拟采用MicroFast®金黄色葡萄球菌测试片,以GB 4789.10—2016第一法[4]为参考方法,参考国际标准ISO 16140-2:2016[5]的性能指标验证要求,对测试片法进行包容性、排他性、灵敏度和相对检出限等进行验证。
1 材料与方法
1.1 试验菌株
选择30株金黄色葡萄球菌目标菌和30株金黄色葡萄球菌非目标菌,菌株来自ATCC、CICC、CMCC、CDMCC以及实验室保存的分离株。
1.2 设备和试剂
MicroFast®金黄色葡萄球菌测试片(型号:LR1305,批号:20240309),美正公司;磷酸盐缓冲液(批号:240408)、7.5%氯化钠肉汤(批号:231118)、血琼脂平板(批号:240330)、脑心浸出液肉汤(BHI)(批号:220107)和冻干血浆(批号:240109),北京陆桥生物技术有限责任公司;Baird-Parker琼脂平板(批号:240415),无锡市赛微生物技术有限公司;匀质器(型号:Interscience 400cc),法国Interscience公司;恒温培养箱(型号:BSP-400),上海博迅实业有限公司医疗设备厂;天平(型号:ME2002/02),梅特勒-托利多国际贸易(上海)有限公司;移液器(型号:100~1 000 μL),艾本德公司;生物安全柜(型号:Thermo-1389),赛默飞世尔科技有限公司。
1.3 试验方法
1.3.1 参考方法
参考《食品安全国家标准 微生物学检验 金黄色葡萄球菌检验》(GB 4789.10—2016)第一法。
1.3.2 研究方法
参照GB 4789.10—2016,无菌称取样品25 g(mL)加入盛有225 mL 7.5%氯化钠肉汤的无菌均质杯或均质袋内,均质后(36±1)℃培养18~24 h。将增菌后的培养物,划线接种到测试片上,(36±1)℃培养18~24 h。培养后,金黄色葡萄球菌菌落显紫色或粉色,非金黄色葡萄球菌菌落会呈现蓝色、灰色或白色。
1.3.3 菌悬液制备
从-80 ℃冰箱中取出保存的菌株,融化后使用无菌接种环将各菌株划线接种于NA琼脂平板中,在其最适宜的培养条件下培养18~24 h。用无菌接种环挑取单菌落,接种于BHI液体培养基,恒温摇床(36±1)℃,160 r·min-1,振摇培养18 h。用无菌PBS进行梯度稀释,用菌落总数测试片进行菌落计数。
1.3.4 包容性和排他性研究
选择表1中30株金黄色葡萄球菌目标菌和30株非目标菌,按照1.3.3制备成菌悬液,按照1.3.2的方法进行检测,记录其检测结果,以验证其特异性。
1.3.5 灵敏度研究
(1)菌悬液制备。按照1.3.3制备成适宜的金黄色葡萄球菌菌液。
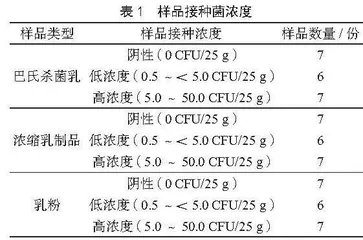
(2)人工污染样本制备及样品前处理。选取巴氏杀菌乳、浓缩乳制品(马苏里拉奶酪)、乳粉3种类型的乳制品,每类称取20份样品,每份样品称取25 g,接种0.1 mL适宜浓度的金黄色葡萄球菌菌液,制备成3个不同浓度水平的接种样品,不同水平的接种浓度和数量见表1(因样品中自然含有背景菌,不再另外接种其他非目标菌)。阴性样品接种0.1 mL的无菌生理盐水。接种后的每份样品中加入225 mL 7.5%氯化钠肉汤培养基,用拍击式均质器拍打1~2 min。
(3)检验。将1.3.5(1)制备好的人工污染样本置于(36±1)℃培养(24±2)h。培养后,按照GB 4789.10—2016第一法和测试片法进行分离鉴定。对于GB 4789.10—2016第一法,选择性平板上出现的典型菌落,按照国家标准要求进行革兰氏染色镜检和血浆凝固酶试验,然后按照国家标准要求进行结果判定。测试片法按照1.3.2进行结果判定。
1.3.6 相对检出限研究
(1)菌悬液制备。按照1.3.3制备成适宜的金黄色葡萄球菌菌液。
(2)制备人工污染样品及样品前处理。称取30份UHT灭菌乳,每份样品量为25 g。接种0.1 mL适宜浓度的金黄色葡萄球菌菌液,制备成3个不同浓度水平的接种样品。不同水平的接种浓度和数量见表2。阴性样品接种0.1 mL的无菌生理盐水。接种后的每份样品中加入225 mL 7.5%氯化钠肉汤培养基,用拍击式均质器拍打1~2 min。
(3)检验。将1.3.6(1)制备好的人工污染样本置于(36±1)℃培养(24±2)h。培养后,按照GB 4789.10—2016第一法和测试片法进行分离鉴定。对于GB 4789.10—2016第一法 选择性平板上出现的典型菌落,按照国家标准要求进行革兰氏染色镜检和血浆凝固酶试验,然后按照国标要求进行结果判定。测试片法按照1.3.2进行结果判定。
2 结果与分析
2.1 包容性和排他性研究结果
30株目标菌在测试片上均长出典型的紫色菌落,30株非目标菌中3株长出非典型的蓝色或蓝紫色菌落,其他23株在测试片上未观察到菌落生长,检测结果见表3和表4。根据试验结果可以看出,MicroFast®金黄色葡萄球菌测试片的包容性和排他性良好。
2.2 灵敏度研究结果
对参考方法和测试片方法的检测结果进行统计,见表5。MicroFast®金黄色葡萄球菌测试片与GB 4789.10—2016参考方法测试结果一致性的汇总数据为PA=36,PD=1,ND=0,NA=24。按照ISO 16140-2:2016中相关指标的计算公式,各性能指标计算结果见表6,满足ISO 16140-2:2016中|ND-PD|不高于3,|ND+PD|不高于6的限值要求。
2.3 相对检出限研究结果
本研究采用3种不同浓度水平的人为污染样本进行重复测试,阴性水平5个样本,低水平即部分检出水平20个样本,高水平5个样本。检出情况汇总见表7。利用ISO 16140-2:2016提供的Excel表计算相对检出限(Relative Limit of Detection,RLOD)为1.000,满足ISO 16140-2:2016中对于RLOD值不高于1.5的要求。
3 结论
本文对乳制品中金黄色葡萄球菌测试片法的应用进行比对研究,针对研究的方法,验证过程选择参照ISO 16140-2:2016验证规则对方法进行充分验证。结果表明,该方法的特异性为100%,相对检出限为1.000,与GB 4789.10—2016方法具有很好的一致性。测试片方法操作和结果判定比较简便,已经在多家乳制品企业中进行应用,不仅为企业内部节省了各项成本,创造了经济效益,还为乳制品行业微生物快速筛查提供了新的选择,整体提高了乳制品致病菌检测技术能力。
参考文献
[1]SCHLECHT L M,PETERS B M,KROM B P,et al.Systemic Staphylococcus aureus infection mediated by Candida albicans hyphal invasion of mucosal tissue[J].Microbiology,2015,161(1):168-181.
[2]HENNEKINNE J A,BUYSER M L D,DRAGACCI S.Staphylococcus aureus and its food poisoning toxins:characterization and outbreak investigation[J].FEMS Microbiology Reviews,2012,36(4):815-836.
[3]中华人民共和国国家卫生健康委员会,国家市场监督管理总局.食品安全国家标准 预包装食品中致病菌限量:GB 29921—2021[S].北京:中国标准出版社,2021.
[4]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验:GB 4789.10—2016[S].北京:中国标准出版社,2016.
[5]International Organization for Standardization.Microbiology of the food chain–method validation–part 2: protocol for the validation of alternative(proprietary) methods against a reference method:ISO 16140-2:2016[S/OL].(2016-06-01)[2025-01-15].https://www.iso.org/standard/54870.html.
作者简介:董彬(1979—),男,吉林白城人,本科,工程师。研究方向:乳制品安全体系建设、精益生产。