辣椒中多种农药残留筛查能力验证
作者: 杨雅雅 周颖雪 王琼妹 吴丽姣 周梦丽 常虹
作者简介:杨雅雅(1990—),女,黎族,广东潮阳人,本科,工程师。研究方向:食品安全与检验检测。
通信作者:常虹(1987—),女,陕西西安人,硕士,高级工程师。研究方向:食品安全与检验检测。E-mail: 375552783
@qq.com。
摘 要:通过分析辣椒中多种农药残留筛查能力验证工作过程及其注意事项,为其他实验室参与多种农药残留筛查能力验证提供参考。依据英国分析实验室能力验证作业指导书及气相色谱-串联质谱法对辣椒中多种农药残留进行筛查,确定目标农药,并进行3次测试。7种目标物质3次测定结果相比较,结果接近,且相对标准偏差均小于10%,测定数值可靠;Z值在0.0~0.6,且3次测定结果的|Z|均≤2.0,本次能力验证结果为满意。
关键词:辣椒;农药残留;气相色谱-串联质谱法
Capability Verification for Screening Multiple Pesticide Residues in Peppers
YANG Yaya1, ZHOU Yingxue1, WANG Qiongmei1, WU Lijiao1, ZHOU Mengli1, CHANG Hong2*
(1.Danzhou Branch of Hainan Academy of Inspection and Testing, Danzhou 571700, China;
2.Institute of Food Testing, Hainan Academy of Inspection and Testing, Haikou 570314, China)
Abstract: By analyzing the process and precautions of the proficiency verification of multiple pesticide residue screening in peppers, a reference is provided for other laboratories to participate in the proficiency verification of multiple pesticide residue screening. According to the operating instructions and gas chromatography-tandem mass spectrometry Food Analysis Performance Assessment Scheme, multiple pesticide residues in peppers were screened, the target pesticides were determined, and three tests were conducted. The three determination results of the seven target substances were compared, and the results were close, and the relative standard deviations were all less than 10%, and the determination values were reliable; the Z value was between 0.0 and 0.6, and the |Z| of the three determination results was ≤2.0, and the results of this proficiency verification were satisfactory.
Keywords: pepper; pesticide residues; gas chromatography-tandem mass spectrometry
辣椒是一年生或多年生草本植物,原产于中南美洲,是中国和世界上消费量最大的调味作物之一,也是餐桌上常见的蔬菜[1-3]。辣椒适应性强、产业链长、营养丰富,在世界范围内具有很高的商业价值。随着辣椒病虫草害日益严重,不规范使用农药造成的辣椒农药残留问题已成为制约辣椒产业发展和辣椒出口的障碍[4]。《食品安全国家标准 食品中农药最大残留限量》(GB 2763—2021)[5]对辣椒中农药残留限量做了比较细致的规定。农药残留监管是保护公众生命安全、提高农产品质量、提高农产品市场竞争力和增强农产品品牌效应的有力保障[6]。
能力验证是采取实验室间的检测比较,根据事先确定的标准来评估参与者检测能力的一种方法[7-9]。
能力验证有利于检验检测实验室对其测定数据的可靠性与准确性进行评估和验证,发现本身存在的问题,从而提高实验室检测技术和实验室管理的水平。中国合格评定国家认可委员会(China National Accreditation Service for Conformity Assessment,CNAS)规定了寻找且参与能力验证,是合格评定机构的责任和义务[10]。在食品检验领域,英国分析实验室能力验证(Food Analysis Performance Assessment Scheme,FAPAS)是享誉世界的国际型评价体系[11],目前有很多检验检测机构主动参与FAPAS能力验证。本实验室参加了FAPAS 19255辣椒农药残留筛查能力验证,结合在能力验证中所做的各项工作,为其他实验室参与多种农药残留筛查能力验证提供相关参考。
1 材料及方法
1.1 材料与试剂
19255能力验证样品(英国FAPAS提供的辣椒测试样品);19255b辣椒空白基质样品(英国FAPAS);乙腈、正己烷(默克,色谱级);氯化钠、甲苯(分析纯);马拉硫磷、喹氧灵(100 μg·mL-1,坛墨质检);氟虫腈砜、b-硫丹、丙环唑、甲氰菊酯、茚虫威(100 μg·mL-1,农业农村部环境保护科研监测所);Agilent盐包(Part No:5982-0650);Agilent净化管(Part No:5982-5256);石墨化碳氨基复合小柱(500 mg/500 mg/ 6mL,Agela)。
1.2 仪器与设备
GCMS-TQ8040气相色谱-三重四极杆质谱联用仪(岛津);SiGMA 2-16KL冷冻离心机(德国SiGMA公司);TYXH-I旋涡混合器(上海三仪实业有限公司);HN132样品浓缩仪(海能品牌);Sartorious CP225D电子天平(北京赛多利斯);T25 digital TURRAX匀浆机(德国IKA公司);EV322旋转蒸发仪(莱伯泰科)。
1.3 标准溶液配制
混合储备液:准确移取100 μg·mL-1马拉硫磷、喹氧灵、氟虫腈砜、b-硫丹、丙环唑、甲氰菊酯和茚虫威各800 μL于10 mL容量瓶,40 ℃氮吹仪氮气吹干后,用正己烷定容至10 mL,得到8 μg·mL-1混合标准储备液。
混合使用液:准确吸取8 μg·mL-1混合标准储备液1 000 μL,用正己烷定容至10 mL,得到0.8 μg·mL-1混合标准使用液。
基质工作溶液:按照样品前处理方法称取19255b辣椒空白基质样品提取空白基质溶液作为溶剂,分别准确吸取10 μL、20 μL、40 μL、60 μL、80 μL、160 μL和240 μL混合标准使用液,用空白基质溶液定容至1 mL,得8 ng·mL-1、16 ng·mL-1、
32 ng·mL-1、48 ng·mL-1、64 ng·mL-1、128 ng·mL-1和
192 ng·mL-1基质工作溶液。
1.4 样品前处理
1.4.1 QuEChERS法
称取10 g辣椒盲样于50 mL离心管中,加入
10 mL乙腈涡旋混合均匀,于冰柜中冷冻20 min,取出,加入一包Agilent盐包(Part No:5982-0650),涡旋器上涡旋1 min,10 000 r·min-1、20 ℃离心5 min。
吸取6 mL乙腈层加入15 mL Agilent净化离心管中(Part No:5982-5256),涡旋器上涡旋1 min,10 000 r·min-1、20 ℃离心5 min,用移液枪准确移取上层清液2 mL于10 mL离心管中,40 ℃氮吹近干,用1 mL正己烷溶剂复溶,涡旋器混合,过0.22 μm有机滤膜于进样瓶中,待测。
1.4.2 固相萃取小柱法
称取20 g辣椒盲样于250 mL高型烧杯中,准确加入40 mL乙腈,用高速匀浆机15 000 r·min-1匀浆2 min,滤纸过滤,收集滤液30 mL以上到装有
6 g左右NaCl的具塞量筒中,盖上塞子,涡旋混合30 s,在室温下静置分层(静置时间为30 min)。
准确吸取10 mL乙腈层溶液于50 mL旋转蒸发瓶中,40 ℃真空下旋转浓缩近干,取出。加入4 mL乙腈-甲苯(3∶1)淋洗液,涡旋混匀,过6 mL石墨化碳氨基复合小柱(先用5 mL淋洗液预洗柱),下端用新的50 mL旋转蒸发瓶接收,用淋洗液淋洗旋转近干的蒸发瓶2次,每次用4 mL淋洗液,防止样品损失,最后用15 mL淋洗液淋洗柱子,合并于新的旋转蒸发瓶中。40 ℃真空下旋转浓缩近干,用正己烷溶剂定容到5 mL,涡旋混合均匀,过0.22 μm有机滤膜于进样瓶中,待测。
1.5 气相色谱-串联质谱条件
进样口温度:250 ℃;不分流进样;进样体积:1 μL;载气:高纯氦气;毛细管柱型号:Rxi-5Sil MS(30 m×0.25 mm,0.25 μm);柱温采用梯度升温模式:起始温度50 ℃保持1 min,以25 ℃·min-1升温至125 ℃,保持0 min,再以10 ℃·min-1升温至300 ℃,
保持15 min。流量控制模式:线速度;柱流量:
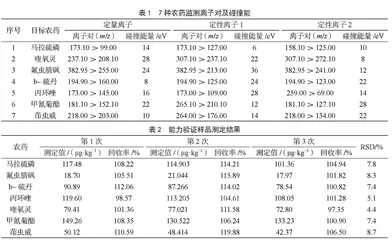
1.69 mL·min-1;溶剂延迟时间:1.5 min;离子源:EI源;离子源温度:200 ℃;电离能量:70 eV;MS接口温度:250 ℃。扫描方式:多反应监测(Multiple Reaction Monitoring,MRM)扫描[12]。MRM条件见表1。
2 结果与分析
2.1 目标农药的确定
本次FAPAS辣椒测试样品涉及的农药及其代谢物共280种,直接购买标准品配制标准液进行筛查,成本高且费时。岛津GCMS-TQ8040气相色谱-串联质谱仪农药残留库涵盖了约850种农药及其代谢物,依据正构烷烃C7~C40进行定位,分组建立MRM方法,对测试盲样处理上机后进行初筛。对疑似检出的农药,再采购标准物质进行定性与定量,最终确定7种目标农药,分别是马拉硫磷、喹氧灵、氟虫腈砜、b-硫丹、丙环唑、甲氰菊酯和茚虫威。
2.2 固相萃取小柱法和QuEChERS法的比较
在确定目标农药后,采用固相萃取小柱法和QuEChERS法两种前处理方法,对空白基质进行加标回收实验。两种方法的检测结果接近,都能得到较满意的回收效果。但石墨化碳氨基复合小柱法使用的溶剂较多,一次使用样品量较大,耗时较长;QuEChERS法具有使用溶剂较少、简便、高效易操作的特点,故最后采用QuEChERS法进行样品检测。
2.3 线性范围及相关系数
用空白基质液配制工作曲线,浓度在0.008~
0.192 μg·mL-1时,7种农药目标物均呈现良好的线性关系,相关系数>0.999,可以满足定量分析要求。
2.4 能力验证样品检测结果
按1.3、1.4.1和1.5节进行样品前处理和仪器测定,一共测定3次,每次2个平行,得到的数据见表2。由表2可知,3次检验的相对标准偏差(Relative Standard Deviation,RSD)<10%,数值稳定可靠,第3次检测结果回收率整体更接近100%,故选择第3次的检验结果上报。