烟草 HSP18.1 基因生信分析及非生物胁迫下表达分析
作者: 刘晨 魏进彬 宋凯 臧志鹏 高玉珍 杨红静 任维贤 张建栋 王祯
摘要 以秦烟1号无菌幼苗为供试材料克隆出 HSP18.1 基因的CDS区,构建重组质粒,对该基因蛋白进行诱导表达及表达条件优化,通过生物信息学分析,研究其在不同组织中非生物胁迫表达。结果表明:该基因属于HSP20家族,全长615 bp,CDS全长579 bp,编码192个氨基酸,且含多个磷酸化和糖基化位点,二级结构以无规则卷曲为主;烟草HSP18.1蛋白与拟南芥HSP18.1蛋白同源,且与多个蛋白相互作用。系统发育表明,烟草HSP18.1与文冠果的亲缘关系较近,与小米椒的亲缘关系较远;在热胁迫下 NtHSP18.1 基因在根、茎叶中被强烈诱导表达,表明 NtHSP18.1 基因是调节植物耐热性的关键。
关键词 烟草; HSP18.1 基因;生物信息学;蛋白诱导表达;热胁迫
中图分类号 S 572 文献标识码 A 文章编号 0517-6611(2025)01-0113-10
doi:10.3969/j.issn.0517-6611.2025.01.023
开放科学(资源服务)标识码(OSID):
Cloning and Expression Analysis of Tobacco HSP18.1 Gene Under Abiotic Stress
LIU Chen, WEI Jin-bin, SONG Kai et al
(Technology Center, Gansu Tobacco Industry Co., Ltd., Lanzhou, Gansu 730050)
Abstract The CDS region of HSP18.1 gene was cloned from the sterile seedling of Qinyan No. and the recombinant plasmid was constructed to induce the expression of the gene protein and optimize the expression conditions. By bioinformatics analysis, the abiotic stress expression of the gene in different tissues was investigated. The results showed as follows: this gene belongs to the HSP20 family, with a total length of 615 bp and a total length of 579 bp for CDS, encoding 192 amino acids, and containing multiple phosphorylation and glycosylation sites, and the secondary structure is mainly random curling;tobacco HSP18.1 protein is homologous to Arabidopsis HSP18.1 protein and interacts with multiple proteins. Phylogenetic results showed that tobacco HSP18.1 was closely related to the fruit, but far related to the millet pepper. The expression of NtHSP18.1 gene was strongly induced in roots, stems and leaves under heat stress, indicating that NtHSP18.1 gene is the key to regulate plant heat tolerance.
Key words Tobacco; HSP18.1 gene;Bioinformatics;Protein induced expression;Heat stress
基金项目 中烟实业科技项目(ZYSY-2022-4)。
作者简介 刘晨 (1987—),男,山东齐河人,工程师,硕士,从事烟草分子生物学与微生物学研究。*通信作者:张建栋,工程师,从事烟草工程研究;王祯,工程师,硕士,从事烟草微生物学研究。
烟草( Nicotiana tabacum )是一种异源四倍体( 2n =48),起源于绒毛状烟草( Nicotiana tomentosiformis )( 2n =24)和美花烟草( Nicotiana sylvestris )( 2n =24)种内杂交后的加倍染色体[1]。烟草是茄科重要的经济作物,在 120 多个国家种植,为世界各国的经济发展作出了重大贡献[2]。然而,烟草在生长发育过程中经常受到各种生物和非生物胁迫的影响,如干旱、病原菌、寒冷、高温、重金属等[3],这些压力会导致生长发育不良、衰老、产量降低,甚至死亡[4]。然而,由于缺乏完整注释的参考基因组,在烟草中许多的基因功能仍未得到探索。
小分子热激蛋白(sHSPs)在植物中含量丰富,种类以及功能多样,是一类重要的胁迫诱导蛋白,在逆境胁迫下的表达增强可提高植物抗御各种逆境因子胁迫的能力。一般来说,根据分子量和序列同源性,HSP可分为5个蛋白质家族:HSP100s/ClpB、HSP90s、HSP70s/DnaK、HSP60s和HSP20s[5]。HSP20又称为小HSP(sHSP),其分子量在12~42 kD[6]。通常,HSP20 以不依赖于 ATP 的方式捕获底物蛋白,并防止应激变性蛋白的不可逆聚集[7]。HSP20 序列包含中央保守结构域、α-晶状体蛋白结构域(ACD),其两侧是可变的 N 端区域和短的 C 端延伸[8]。ACD是HSP20的标志结构域,含有80~100个氨基酸,其在植物中的结构是β-三明治,包括反向平行方向的三链和四链以及延伸链[9]。与其他 HSP 家族不同,HSP20 家族在植物界变异性更大,且趋于分化[9]。根据亚细胞位置,HSP20蛋白可分为12个亚家族(CI、CII、CIII、CIV、CV、CVI、CVII、MI、MII、ER、P和Po)[9]。Hsp20也是植物中变异最大、最多样化的家族之一,被认为是许多高等植物在热应激条件下产生最多的蛋白质之一。植物 sHSP 的体内功能很大程度上未知,很少有研究证明其作为体外分子伴侣的功能[10]。由于植物在生长季节甚至白天经常暴露在次优的环境条件下,因此它们必须形成保护机制。由于其丰富度(高达总蛋白的 1%),sHSP 被认为直接参与其中体内耐热性,并且热休克转录因子表达失调导致组成型 sHSP 表达的转基因植物确实表现出增强的耐热性[11]。植物 sHSP的大小为 200~240 kD,未证明磷酸化作用,豌豆 HSP18.1 由排列成球状结构的 12 个亚基组成[12],豌豆 HSP18.1蛋白已被证明可以结合其表面的热变性蛋白,并将其保持可折叠状态。
目前国内对烟草 NtHSP18.1 基因的研究鲜见报道。因此,为了研究植物sHSP的行为,笔者克隆了烟草 NtHSP18.1 ,它是 sHSP 胞浆 I 类家族的成员,在成熟烟草花粉粒中微弱表达,并在体外花粉胚胎发生过程中由饥饿应激诱导。笔者首先克隆了该基因,在大肠杆菌中过表达NtHSP18.1蛋白,确认该蛋白原核生物重组表达的可行性,为后续对NtHSP18.1蛋白离体研究提供理论基础,并通过生物信息学分析了该基因编码蛋白的基本性质。该研究结果可为烟草 NtHSP18.1 基因功能鉴定提供参考,为进一步提高烟草抗逆性研究提供参考。
1 材料与方法
1.1 材料
试验所用烟草(秦烟1号)来自甘肃烟草工业有限责任公司生物实验室,基因克隆所用材料为无菌苗幼叶。
1.2 方法
1.2.1 HSP18.1 基因克隆。
取烟草(秦烟1号)叶片不同部位剪取小块组织约0.2 g,加无菌水清洗1遍,保存于液氮中,用于总RNA的提取。
总RNA的提取与反转录:采用Trizol法提取烟草叶片的总RNA[13],然后参照cDNA合成试剂盒的方法,进行反转录及cDNA合成。
在烟草基因组数据库下载 HSP18.1 基因的编码序列(coding sequence,CDS),设计特异性引物,上、下游引物hsp18-F、hsp18-R序列分别为GAATTCAATGTCTCTTATCCCAAGCATTTTCGGTGG、CTCGAGGTGGTGGTGGTGACCAG-ATATCTCAATGGCTTT。以烟草幼苗cDNA为模板,利用特异引物扩增目的基因,通过琼脂糖凝胶电泳进行检测目的基因,PCR反应总体系为30 μL,其中LA TAQ PCR Mix 10 μL,Primer Mix 2 μL,Nuclease-free water 3 μL,cDNA模板5 μL,用ddH 2O补充至30 μL。PCR反应程序:95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火40 s,72 ℃延伸1 min;40个循环,最终72 ℃延伸10 min。将上述目标CDS扩增产物通过胶回收试剂盒对目的基因进行纯化回收,将纯化后的目的片段连接至T载体,利用热激转化法转入DH5α大肠杆菌( Escherichia coli ),通过蓝白斑筛选,获得阳性克隆,进行菌液PCR检测并测序,合适序列用于后期序列分析。
1.2.2 HSP18 基因重组质粒构建。
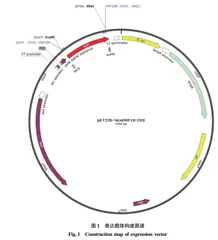
先将目的基因产物纯化后,连接到pMD-19T载体,转化筛选阳性克隆并测序。再将载体pET22b-HIS(图1)和携带有 HSP18 目的基因的pMD-19T载体用限制性核酸内切酶EcoR Ⅰ和Xho I酶切90 min,经琼脂糖凝胶电泳回收纯化目的基因片段和质粒骨架,在T4连接酶作用下16 ℃连接过夜。然后将连接产物转化TOP10克隆宿主感受态细胞,在氨苄青霉素抗性平板上筛选阳性克隆转化子。最后挑取转化子,并提取质粒双酶切验证转化大肠杆菌表达宿主BL21(DE3)与Rosetta(DE3),对重组质粒进行平板筛选和测序。
1.2.3 rHSP18.1的诱导表达及表达条件优化。
用LB氨苄青霉素平板活化重组菌株,分别挑取BL21(DE3)与Rosetta(DE3)单菌落接入2 mL含有终浓度50 μg/mL氨苄青霉素的LB试管中,培养15 h后再按2%接种量转接于5 mL LB发酵培养基中,37 ℃ 200 r/min培养至OD 600约为0.8后,用不同浓度的IPTG进行诱导,分别添加终浓度为0.5、1.0 mmol/L IPTG,30 ℃ 200 r/min诱导12 h后,离心12 000 g×30 s收获沉淀菌泥,进行 SDS-PAGE、Western Blot分析,Western Blot检测中使用上海生工Anti-His Tag抗体特异性检测带有His tag的rHSP18.1目标蛋白,以确认目标蛋白是否表达。
1.2.4 HSP18.1 编码蛋白的基本结构分析。
通过Expasy平台的ProtParam tool工具对 HSP18.1 基因编码蛋白的基本理化性质进行分析。根据Relative mutability参数,Zimmerman方案,Hopp & Woods方案,Transmembrane tendency参数,Average flexibility参数,Janin方案,预测蛋白相对突变性、极性、亲水性、跨膜性、柔韧性、可及性理化性质等一级结构。通过NPS@:GOR4软件(https:∥npsaprabi.ibcp.fr/cgibin/-npsa_automat.pl?page=npsa_gor4.html)预测该基因编码蛋白的二级结构;TMHMM-2.0(https:∥services.healthtech.dtu.dk/services/TMHMM-2.0/)在线网站用于预测该基因编码蛋白的跨膜结构域;SignalP 5.0(https:∥services.healthtech.dtu.dk/services/SignalP-5.0/)用于预测编码蛋白的信号肽;利用 Scratch Protein Predictor 软件的Dlp功能对该蛋白的二硫键进行预测;运用NetPhos 3.1(https:∥services.healthtech.dtu.dk/service.php?NetPhos-3.1)在线软件对磷酸化位点进行了预测;NetOGlyc 4.0(https:∥services.healthtech.dtu.-dk/service.php?NetOGlyc-4.0)用于预测糖基化位点。在NCBI的功能界面 CDD 网站(https:∥www.ncbi.nlm.nih.gov/Structure/-cdd/wrpsb.cgi)对 HSP18.1 基因编码蛋白的结构域进行了预测。通过 SWISSMODEL(https:∥swissmodel.expasy.org/)对 HSP18.1 基因编码蛋白的三维结构进行同源建模[14]。蛋白互作分析借助String(https:∥cn.string-db.org/)在线网址,以拟南芥已知网络为基础。通过DNAMAN进行多序列比对,并使用MEGA-X 软件的邻接法(neighbor-joining,NJ)构建系统进化树,重复次数为1 000,分析其进化关系[15]。