通过式固相萃取超高效液相色谱串联质谱测定水产品中兽药残留
作者: 张翀宇 王展华 施贝 赵超群 朱蕾颖 金绍强 梁晶晶
摘要 [目的]采用通过式固相萃取超高效液相色谱串联质谱法,对水产品中的兽药残留进行检测。[方法]对样品进行80%乙腈提取,利用OasisPRiMEHLB固相萃取小柱对提取液进行富集净化,采用0.1%甲酸水-乙腈溶液作为流动相进行梯度洗脱。运用串联质谱电喷雾正、负离子扫描模式,结合质谱多反应监测(MRM)模式进行分段扫描,并通过外标法进行定量分析。[结果]10种兽药残留在10~200 ng/mL线性关系良好(R2>0.99)。方法的检出限为0.24~4.07 μg/kg,定量限为0.07~1.22 μg/kg。在10、50、100 μg/kg的加标浓度下,回收率为80.64%~117.52%,相对标准偏差(RSD)为1.3%~6.6%。[结论]该研究构建的兽药残留检测方法具有前处理简便、净化效能显著、灵敏度高等优势,可以满足动物源性食品中兽药残留的检测需求。
关键词 兽药残留;超高效液相色谱串联质谱法;水产品
中图分类号 TS 254.7 文献标识码 A 文章编号 0517-6611(2025)05-0161-04
doi:10.3969/j.issn.0517-6611.2025.05.034
Determination of Veterinary Drug Residues in Aquatic Products by Ultra-high Performance Liquid Chromatography by Tandem Mass Spectrometry
ZHANG Chong-yu,WANG Zhan-hua,SHI Bei et al
(Zhejiang Institute of Food and Drug Control/Key Laboratory of Functional Food Nutrition and Quality Safety for State Market Regulation/Key Laboratory of Health Food Quality Safety of Provincial Market Regulation, Hangzhou,Zhejiang 310052)
Abstract [Objective]To detect veterinary drug residues in aquatic products by using the formula solid phase extraction-ultra high performance liquid chromatography tandem mass spectrometry.[Method]After 80% acetonitrile extraction using Oasis PRiME HLB solid phase extraction column enrichment purification and isolated components, 0.1% formic acid water-acetonitrile solution in the mobile phase proportional gradient elution, in series mass spectrum electrospray positive and negative ion scanning mode, using mass spectrometry multi-reaction monitoring (multiple reaction monitoring, MRM) mode segment scanning, quantified by external standard method. [Result]The 10 veterinary drug residues showed good linear relationship between 10 and 200 ng/mL (R2>0.99), the detection limit of method was 0.24-4.07 μg/kg, the limit of quantification was 0.07-1.22 μg/kg.At spiked concentrations of 10, 50, and 100 μ g/kg, the recovery rate was 80.64%-117.52%, the relative standard deviation (RSD) was 1.3%-6.6%.[Conclusion]The method for detecting veterinary drug residues constructed in this study has the advantages of simple pretreatment, significant purification efficiency and high sensitivity, which can meet the detection needs of veterinary drug residues in animal derived foods.
Key words Veterinary drug residues;Ultra-high performance liquid chromatography tandem mass spectrometry;Aquatic product
兽药残留是指在食品动物使用药物治疗或长期摄入含有药物的饲料后,其源性食品中所残留的兽药原型或其代谢产物,以及与之相关的杂质。目前,导致兽药残留超标的主要原因涉及多个方面:一是抗菌药和药物添加剂的滥用,二是对休药期规定的不遵守,三是非法使用违禁药物。兽药残留的来源不仅限于畜禽疾病的治疗用药,还包括饲料中添加的某些成分、动物性食品的保鲜措施,以及促生长饲料添加剂的使用,甚至环境中污染物质的接触或摄入等[1]。由于部分养殖户受到经济利益的驱使,或对兽药残留潜在危害性的认识不足,导致畜禽产品中的兽药残留问题日益严重。目前,兽药残留已成为公众广泛关注的焦点。例如,农业农村部近期发布的2023年国家产地水产品兽药残留监控报告显示,全国产地水产品兽药残留监测合格率高达99.5%[2]。
在动物源性食品中,兽药残留超标的问题尤为突出,主要涉及抗生素类、磺胺类、呋喃类、抗寄生虫类和激素类药物等,水产品中常用的兽药包括孔雀石绿、硝基呋喃类药物、氯霉素、地西泮、氟喹诺酮类等[3]。鉴于水产品已成为日常饮食的重要组成部分,兽药残留超标可能对人体健康产生深远影响,如引发急性或慢性中毒反应,产生“三致”作用(致畸、致癌、致突变),增加治疗难度,产生激素样作用,甚至对生态环境造成污染。历史上已有瘦肉精羊肉、喹诺酮蜂蜜、喹乙醇兔肉等事件[2]。此外,食品中药物残留的污染还加速了抗菌素耐药性的产生,对全球公共健康构成严重威胁。因此,必须严格控制兽药使用,确保食品安全[4]。
目前,针对兽药残留的检测普遍采用胶体金免疫层析法(GLGA)、酶联免疫吸附法(ELISA)、高效液相色谱法(HPLC)、高效液相色谱串联质谱法(HPLC-MS/MS)等方法[5-7],这些方法在兽药残留检测领域均得到了广泛应用,并且具有一定的准确性和可靠性。
笔者运用通过式OasisPRiMEHLB固相萃取小柱对样品进行预处理,并与超高效液相色谱串联质谱法相结合,成功实现对鱼肉中10种兽药残留的检测,包括喹诺酮类(环丙沙星、恩诺沙星、氧氟沙星、洛美沙星、培氟沙星、诺氟沙星)和四环素类(四环素、土霉素、金霉素、多西环素)药物,以期为兽药残留检测工作提供了技术支撑。
1 材料与方法
1.1 试验材料
1.1.1 标准品。13种沙星混合标准品溶液,纯度100%,北京曼哈格公司,批次号为F0032066。盐酸-恩诺沙星-D5,纯度99.8%,WITEGA,批次号为30174006。盐酸-环丙沙星-D8,纯度99.9%,ANPEL,批次号为2104943。诺氟沙星-D5,纯度99.3%,ANPEL,批次号为M3960100。四环素,浓度100 μg/mL,北京曼哈格公司,批次号为E0030290。土霉素,浓度100 μg/mL,北京曼哈格公司,批次号为E0030290。金霉素,浓度100 μg/mL,北京曼哈格公司,批次号为E0030290。多西环素,浓度100 μg/mL,北京曼哈格公司,批次号为E0030290。
1.1.2 耗材。OasisPRiMEHLB(200 mg,6 mL)固相萃取柱,上海沃特世公司;0.22 μm PTFE过滤头,美国安捷伦公司。
1.1.3 试剂。乙腈(质谱纯,德国默克公司);甲醇(质谱纯,德国默克公司);甲酸(色谱纯,美国默克公司),除已注明外,所用试剂均为分析纯。
1.1.4 仪器与设备。
ShimadzuLC-30A高效液相色谱仪(日本岛津公司);Milli-Q超纯水仪(德国Millipore公司);AB SCIEX 5500三重四极杆液质联用仪(美国ABSciex公司);MultiReax多通道旋涡混合器(德国Heidolph公司);LYNX6000超速离心机(美国Thermo公司);XPE205分析天平(瑞士Mettler公司);全自动平行浓缩仪(厦门睿科集团股份有限公司)。
1.2 试验方法
1.2.1 标准溶液的配制。
1.2.1.1 标准品储备液。13种沙星混合标准品溶液、四环素、土霉素、金霉素、多西环素为外购液体储备液,浓度分别为0.1、100.0、100.0、100.0、100.0 μg/mL。
1.2.1.2 内标储备液。精确称取盐酸-恩诺沙星-D5标准品12.34 mg,用乙腈定容至25 mL,配制成浓度为0.493 6 mg/mL的盐酸-恩诺沙星-D5内标储备液。精确称取盐酸-环丙沙星-D8标准品12.44 mg,用乙腈定容至25 mL,配制成浓度为0.497 6 mg/mL的盐酸-环丙沙星-D8内标储备液。精确称取诺氟沙星-D5标准品12.71 mg,用乙腈定容至25 mL,配制成浓度为0.508 4 mg/mL的诺氟沙星-D5内标储备液。
1.2.1.3 混合标准工作液。分别精确量取13种沙星混合标准品储备液、四环素标准品储备液、土霉素标准品储备液、金霉素标准品储备液、多西环素标准品储备液0.02 mL置于2 mL容量瓶中,并用甲醇稀释至刻度,得到混合标准品中间液A。
精确量取1.0 mL混合标准品中间液A置于10 mL容量瓶中,用甲醇稀释至刻度,得到混合标准品中间液B。
精密量取各内标储备液0.20 mL置于10 mL容量瓶中,用甲醇稀释至刻度,得到混合内标中间液,浓度约为10 μg/mL。
精密量取混合内标中间液1.0 mL置于10 mL容量瓶中,用甲醇稀释至刻度,得到混合内标使用液,浓度约1 000 ng/mL。
1.2.2 样品的前处理。
准确称取约2 g的试样(精确至0.01 g),并将其置于50 mL离心管中,随后加入10 mL的90%乙腈水溶液,通过振荡的方式提取30 min,确保充分混合和反应。试样置于4 ℃的环境下,并以9 000 r/min离心5 min。离心后,取全部上清液采用primeHLB固相萃取柱收集全部的流出液,45 ℃的条件下使用氮气吹干,使用2.0 mL的水-0.1%甲酸甲醇溶液来溶解残渣。使用0.22 μm的PTFE过滤头将溶液过滤至进样瓶中,待进一步测定。
1.2.3 检测条件。
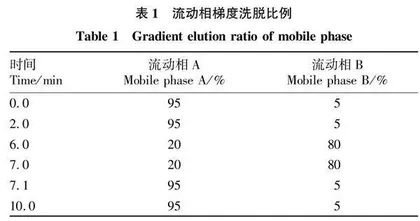
1.2.3.1 色谱条件。色谱柱为Waters Acquity UPLC BEH C18(100 mm×2.1 mm,1.7 μm);柱温35 ℃;岛津LC-30AD超高效液相色谱系统串联AB SCIEX 5500 三重四极杆质谱仪(包括二元泵、在线脱气机、自动进样器);流动相为0.1%甲酸混合水溶液(A)、0.1%甲酸甲醇-乙腈混合溶液(V/V=1/1)(B);梯度洗脱程序见表1;流速0.35 mL/min;进样量2 μL。