高山杜鹃组培快繁关键技术研究
作者: 南雅琪 刘娟 齐宇 董飞 王成鹏 马蕾 王烨楠 吕晓惠 朱娇
摘要 以高山杜鹃品种“23XXL”“5RE”及“6GR”的叶片、茎段、苞片为外植体,研究基本培养基、外植体生理年龄及植物生长调节剂对高山杜鹃外植体愈伤组织诱导的影响。结果表明,高山杜鹃外植体在WPM培养基和MS培养基上均能诱导出愈伤组织。愈伤诱导阶段,添加2.0~3.0 mg/L TDZ诱导愈伤效果好,其中外植体生理年龄为2W叶片诱导的愈伤组织生长较好,愈伤诱导率最高为100%;愈伤分化阶段,最适宜的愈伤组织分化激素配比为ZT 2.5 mg/L+NAA 0.5 mg/L和TDZ 1.5 mg/L+NAA 1.0 mg/L,其中外植体生理年龄为1M叶片在Z7培养基愈伤组织分化较好,平均芽分化数为0.92;生根阶段,培养基最佳激素配比IBA 0.5 mg/L+NAA 1.0~1.5 mg/L均适合高山杜鹃的3种品种。该研究结果为构建高效、稳定的高山杜鹃组培快繁体系提供科学依据,为进一步实现高山杜鹃产业化奠定基础。
关键词 高山杜鹃;组织培养;外植体;植物生长调节剂
中图分类号 S 685.21 文献标识码 A 文章编号 0517-6611(2024)22-0042-05
doi:10.3969/j.issn.0517-6611.2024.22.007
开放科学(资源服务)标识码(OSID):
Research on Key Techniques for Tissue Culture of Rhododendron lapponicum
NAN Ya-qi LIU Juan3,QI Yu1 et al
(1.Institute of Leisure Agriculture,Shandong Academy of Agricultural Sciences /East China Urban Agriculture Key Laboratory of the Ministry of Agriculture and Rural Affairs/Shandong Engineering Research Center for Ecological Horticultural Plant Breeding, Jinan, Shandong 250100; 2.College of Horticulture and Landscape Architecture, Tianjin Agricultural University, Tianjin 300000; 3. Shandong Hongmei Horticultural Technology Co., Ltd., Rizhao, Shandong 276800)
Abstract This study used the leaves, stem segments, and bracts of alpine rhododendron varieties ‘23XXL’‘5RE’and‘6GR’ as explants to investigate the effects of basic culture medium, physiological age of explants, and plant growth regulators on callus induction in alpine rhododendron explants. The results showed that the explants of alpine rhododendron could induce callus on both WPM and MS media. During the callus induction stage, adding 2.0-3.0 mg/L TDZ had a good effect on inducing callus. Among them, the callus induced by leaves with a physiological age of 2W had better growth, and the highest callus rate was 100%;at the stage of callus differentiation, the most suitable ratio of callus differentiation hormones was ZT 2.5 mg/L+NAA 0.5 mg/L and TDZ 1.5 mg/L+NAA 1.0 mg/L. Among them, the explant with a physiological age of 1M had better callus differentiation on Z7 medium, with an average number of bud differentiation of 0.92;during the rooting stage, the optimal hormone ratio of the culture medium was IBA 0.5 mg/L+NAA 1.0-1.5 mg/L, which were suitable for the three varieties of alpine rhododendron. The research results provide a scientific basis for constructing an efficient and stable tissue culture and rapid propagation system of alpine rhododendron, and lay a foundation for further realizing the industrialization of alpine rhododendron.
Key words Rhododendron lapponicum;Tissue culture;Explants;Plant growth regulator
高山杜鹃一般是指以杜鹃亚属、常绿杜鹃亚属、马银花亚属为主的生长在海拔较高的地区的常绿杜鹃以及其经过上百年杂交培育出的园艺品种,其花色繁多,花团锦簇,极具经济价值和观赏价值[1]。
当前国内高山杜鹃的研究开发和推广应用方兴未艾,在全国园林花卉大发展的背景下,高山杜鹃的市场潜力巨大[2]。然而国内高山杜鹃产业存在以下问题:第一,国内优质高山杜鹃品种主要依赖进口,缺乏具有自主知识产权的新优品种[3]。我国大部分栽培品种为欧洲选育的高山杜鹃品种,耐寒性强,但缺乏抗旱、耐热性状[4];第二,高山杜鹃为木本植物,生长周期长,养护成本高,生产企业积极性不高,导致产业发展缓慢;第三,扦插不易成活、种苗依赖进口,价格高。部分高山杜鹃品种缺乏完善、高效稳定的组培繁育技术体系,种苗质量得不到保障[5-6],使得高山杜鹃进口种苗价格昂贵,不利于产业化推广。
笔者针对目前高山杜鹃品种组培体系不完善、高效稳定的组培繁育技术缺乏、种苗质量参差不齐等问题,以引入的高山杜鹃种质资源为材料,开展高山杜鹃的种苗繁育关键技术研究,探索杜鹃花种质创新的途径和方法,实现种苗的高效繁育,为高山杜鹃产业可持续发展奠定基础。
1 材料与方法
1.1 试验时间和地点
试验于2023年3—8月在山东省农业科学院休闲农业所观赏园艺课题组实验室进行。
1.2 试验材料
高山杜鹃“23XXL”“5RE”“6GR”种质资源,种植于山东省农业科学院休闲农业研究所观赏园艺课题组温室,常规栽培管理。
选用WPM、MS作为基本培养基,使用激素有TDZ、ZT、NAA、IBA。
1.3 试验方法
1.3.1 外植体取材及消毒方法。
采用“23XXL”高山杜鹃品种的叶片、茎段、苞片为外植体材料,其中叶片按照新叶长出时间分为生长7 d(1W)、14 d(2W)、30 d(1M)3种;茎段按照生长时间分为生长30 d的茎段(JM)、14 d的茎段(J2W);苞片(bp)。
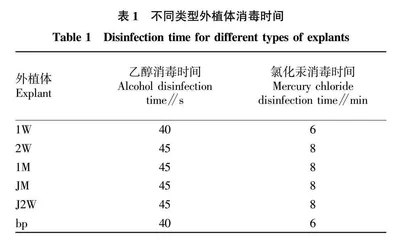
将外植体用洗洁精浸泡10 min后,搓洗叶片表面黏腻的绒毛和茎段表面的污垢,用流水冲洗干净,放置无菌瓶中备用。倒入75%乙醇消毒。其中,1W叶片消毒40 s,2W叶片消毒45 s,苞片(bp)消毒40 s,1M叶片消毒45 s,JM(茎段30 d)消毒45 s,J2W(茎段14 d)消毒45 s,外植体消毒要晃动瓶身,使其均匀消毒。后分别夹到无菌瓶中,倒入0.1%氯化汞1W叶片、苞片(bp)消毒6 min,2W叶片、JM(茎段30 d)、J2W(茎段14 d)均消毒8 min。消毒期间不断晃动瓶身,使外植体与消毒液充分接触,使其消毒彻底(表1)。
消毒后的外植体,用无菌水冲洗3~5遍,放入无菌盘中,切除茎段两头褐化部位,叶片切除叶尖、叶柄和叶片两侧备用。
1.3.2 愈伤组织诱导方法。
愈伤组织诱导培养基分为A1~A6,其中A1~A5以WPM为基本培养基,A6以MS为基本培养基,同时附加不同浓度的植物生长调节剂、蔗糖30 g/L、琼脂6 g/L,培养基调制为pH 5.8,具体配比见表2。将叶片切成大小均等4块,背部朝下接入诱导培养基中,每瓶接种4片,每个处理5瓶,3个重复。暗培养14 d后,培养光照强度1 500~1 800 lx,光照时间12 h/d,培养温度(24±2)℃。接种30 d后统计愈伤组织的诱导率、褐化率。
1.3.3 愈伤组织分化处理方法。
分化培养基以WPM为基本培养基,附加不同浓度的细胞分裂素TDZ、ZT和生长素NAA,同时添加蔗糖30 g/L,琼脂6 g/L,调pH至5.8,具体配比见表3。将“23XXL”外植体诱导的愈伤组织接种到分化培养基中,每瓶接种4块,每个处理5瓶,3个重复。暗培养14 d后,培养光照强度1 500~1 800 lx,光照时间12 h/d,培养温度(24±2)℃,培养30 d后观察生长情况并统计平均芽分化数。
1.3.4 组培苗生根处理方法。
当丛生芽生长至3~5 cm时,将其从基部切割,接种至生根培养基上。生根培养基以WPM为基本培养基,添加不同浓度的生长素NAA和IBA,同时添加蔗糖30 g/L、琼脂6 g/L、活性炭1 g/L,pH调至5.8,具体配比见表4。生根培养基为g1~g5,其中g5培养基放入活性炭,接种后的丛生芽,暗培养14 d后,光照强度1 500~1 800 lx,光照时间12 h/d,培养温度(24±2)℃,35 d后观察生根情况并统计生根率。
1.4 数据分析
采用DPS软件和Excel软件进行各数量性状的诱导率、分化数、生根率计算。
诱导率=诱导愈伤的总数/接种外植体数×100%
褐化率=褐化的总数/接种外植体数×100%
平均芽分化数=分化出的芽总数/接种中间繁殖体数
生根率=生根株数/诱导株数×100%
2 结果与分析
2.1 不同培养基对高山杜鹃愈伤组织诱导的影响
高山杜鹃外植体接入培养基后,先进行暗培养,14 d后再进行光照培养。叶片接入培养基7 d后,边缘出现卷曲现象,开始形成愈伤组织,其他外植体无任何变化;接入14 d后,茎段开始长出愈伤,1W叶片相比其他生长期的叶片长出愈伤数量较多;苞片接种20 d后,才开始诱导愈伤组织。30 d天后观察并统计高山杜鹃外植体诱导愈伤情况和褐化死亡情况。